康蓝药业姜能桥|打造符合欧美市场要求竞争力的原料药企业

药融圈第140场专享会嘉宾:康蓝药业总经理 姜能桥

武汉康蓝药业有限公司专注于生物医药产品的生产,主要生产产品方向为抗肿瘤药物及高技术、高价值药物。公司按GMP、cGMP、EUGMP规范标准建设的生产,工厂已于2014年9月竣工投产。
本次分享主题从以下六点出发:
一、观念的建立;
二、工厂设计;
三、文件体系的建立;
四、DMF文件的准备;
五、现场检查;
六、缺陷整改。
1.观念的建立
首先从观念的建立和大家分享,目前让大家混淆不清的概念有:API 原料药和化工品的区别;原料药企业和化工企业的区别。其实我们所说的化工品是质量指标的合规性,而API 是质量体系上的合规性,在本质上有很大的区别。
我们从事API 包括做关键中间体的企业,在工艺研究方面可以从工艺的稳定性着手,关键中间的开发以及生产概念。
2.工厂设计
观念建立之后,把我们的关键融入工厂设计中,在工厂设计中必须研究法律法规对工厂管理的要求,必要的设施、分区、以及便于管理的概念要充分融入工厂设计当中,当然这其中也包括环保。以我多年工厂建设和工厂管理经验来看,环保并不是单纯投资的问题,而是技术性问题。只是之前的观念没有改变,做环保跟做产品一样,要对整个三废的产生以及储值进行全面的分析,然后进行系统的规划与设计。在工厂设计必须充分考虑安全的措施,从技术角度以及管理的角度来设计工厂布置以及生产流程。
工厂在流程设计的时候必须充分考虑管理的介入,把管理的概念投入进来,这要很多工厂的经验才可以做好这件事情。
检测系统体就是现在的化验室、实验室。实验室设计也要充分考虑法规上的要求。符合质量源于设计,新建的工厂包括老工厂改造的时候,必须从顶层设计考虑工厂的合规性。只有在设计时考虑了各个方面的合规性,工厂才能做到投资最省,管理的便捷以及合规性。设计环节考虑的不充分,后期就会花大量的人力、物力、财力去解决问题。
3.文件体系的建立
我们的原料药要进入欧美的原料药市场,重要的环节就是要充分研究法规的基础上建立完善的质量体系。文件体系建立是非常困难的事情,目前很多的工厂在这个问题上比较困惑。这里给大家一些建议:
第一:要想文件可以有效的运行,就要从公司的组织架构来建立文件的主要框架,再按照各个要求来完善文件体系;
第二:在文件体系完全没有建立的基础条件下,我们的文件建立以及文件运行,也要跟工厂进行充分的融合,检验文件的可操作性是否符合法规,是否需要修改;
第三:体系文件的建立要请比较有经验,有文件建立的咨询公司来进行整体设计。
4.DMF文件的准备
从工厂的建设设计,体系文件建立之后,我们在做产品稳定时,首先要解决工艺开发的问题,国内工艺开发相对来说做的比较粗糙,DMF文件的准备:生产产品工艺路线的确定、生产用到的原辅料、中间体、包装材料、成品质量标准的建立、分析方法的建立。
工艺开发还在优化阶段时,后期很多工作就无需开展,因为工艺开发是关键,涉及到后期质量研究文件的工作进度,在工艺开发过程中首先建立质量控制、杂质的控制是非常重要的。
为什么说杂质控制是关键,目前我们很多产品生产过程中会涉及到潜在杂质,特别是基因毒性杂质。如果之后出现了其它杂质特别是基因毒性杂质,那之前做的工作就前功尽弃了。
基本的流程是工艺开发已经完善的前提下,前面开展质量研究包括分析方法验证和相关杂质研究,在完成分析方法验证或者分析方法确认之后,确定的工艺确认下再进行工艺预验证。完成之后同步进行生产工艺验证,基本工作完成之后才能开展生产工艺验证。

5.现场检查
如果有激活的客户要安排现场检查,现场检测一般是三天。检测内容 从物料进场到产品销售全流程的检查,最关键是现场提问以及回答。一般检测当中检察官提的问题需要认真的回答,在官方审计之前企业需要进行充分的准备,相关人员的培训如何回答检查官的提问以及 ,如何来保证检查流程中良好的印象。
检查缺陷的整改,就是483 没给483 也会给一些小的缺陷,这些问题一般会写在EIR报告里面,对检查发现的问题,企业要尽快给出具体的整改方案以及计划,并且按照方案计划去完成。下一次的检查肯定会优先检查上一次的完成情况。如果企业未按照方案和计划完成肯定会收到警告信,信任度将会受到极大的怀疑。
我建议大家今后在工艺研究方面多下点功夫。1、可以解决成本问题;2、可以解决质量问题;3、更可以解决合规性问题。总体竞争力增强!
基本的流程是工艺开发已经完善的前提下,前面开展质量研究包括分析方法验证和相关杂质研究,在完成分析方法验证或者分析方法确认之后,确定的工艺确认下再进行工艺预验证。完成之后同步进行生产工艺验证,基本工作完成之后才能开展生产工艺验证。
6. 缺陷整改
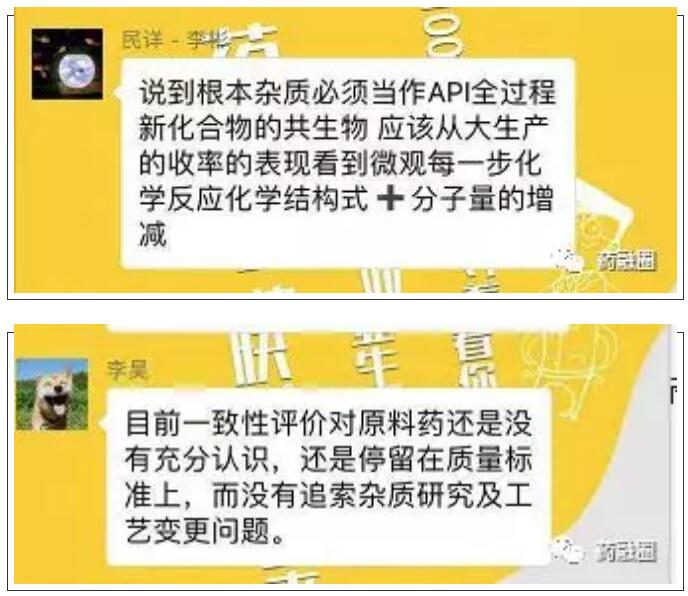
国内目前一致性评价中普遍碰到也是原料药的问题。我一个朋友二个产品BE都做完了,报国家局因为原料药问题被退回,花费了二千多万。目前一致性评价对原料药还没有充分认识,停留在质量标准上,而没有追索杂质研究及工艺变更问题。杂质研究的关系还是在工艺研究方面,研究的目的是为了控制杂质限度,最终回归到工艺优化问题。做制剂研究的很多不了解原料药,当然很难做好制剂一致性评价。
1992年我在做阿洛西林时,稳定性一直没有解决,我仔细研究工艺过程后重新设计工艺流程后就解决了,后面成为金华康恩贝独家产品。
其实做原料药经验和思路很重要,有些问题靠反应解决,有些问题靠工程装备解决,有些问题要靠流程再造解决。我做杂质工艺优化很少考虑用柱分离,更多考虑混合溶剂法。12年我接了一个老外的创新药小试工艺要完成公斤级工艺验证,每步都用柱子分离,我二个月内全改了,收率质量更好。
当年我师弟帮花园做VD3结晶研究一年多无进展,后求助我,我问了一下VD3特性后给了他一个思路,回去就做出来了。我们公司产品杂质限度都做的非常低,培美总杂质<0.10%,单杂<0.03%。

分享会激烈讨论部分展示
提问环节

天津民祥李彬提问:
新工厂设计前,工厂的URS需求计划这块,姜总有什么好的经验?
姜能桥回答:
URS主要是技术和法规方面,特别是从法规方面进行评估。

上海峰威化工朱向阳提问:
溶剂/母液回收套用验证在工艺研究时考虑吗?
回答:
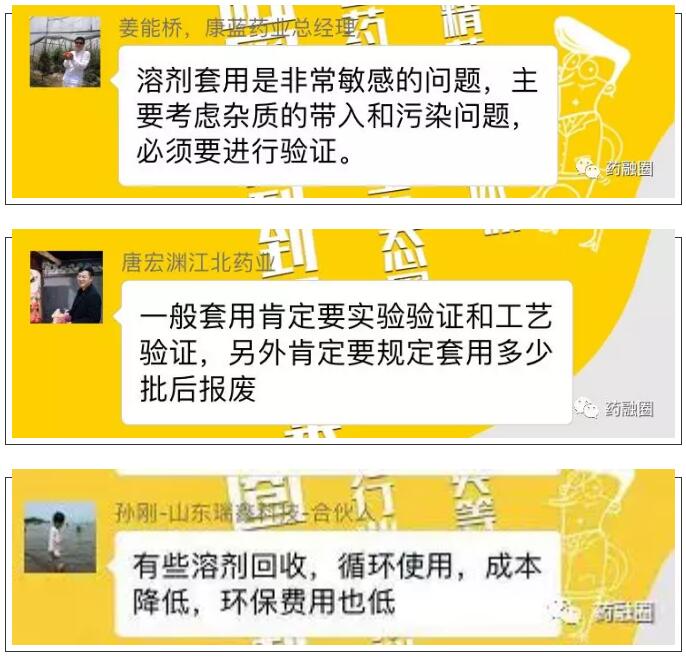
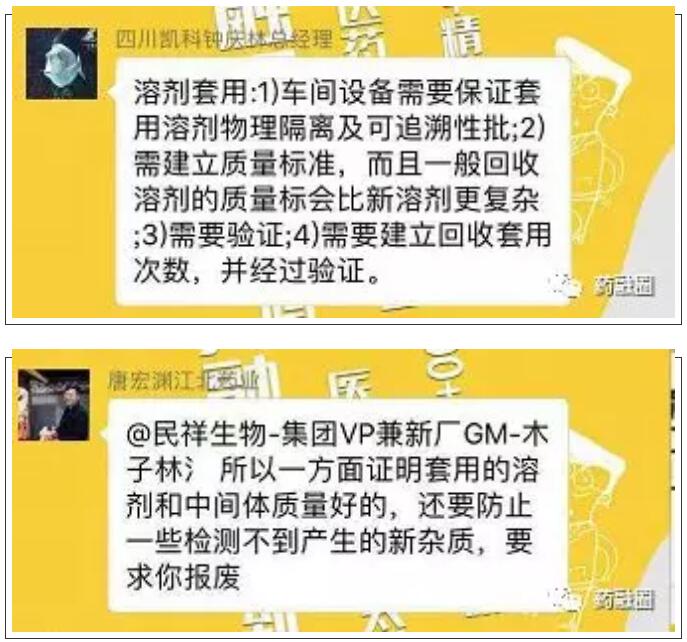
引起的话题讨论一

目前一致性评价对原料药还没有充分认识,停留在质量标准上,而没有追索杂质研究及工艺变更问题。
引起的话题讨论二

提问:
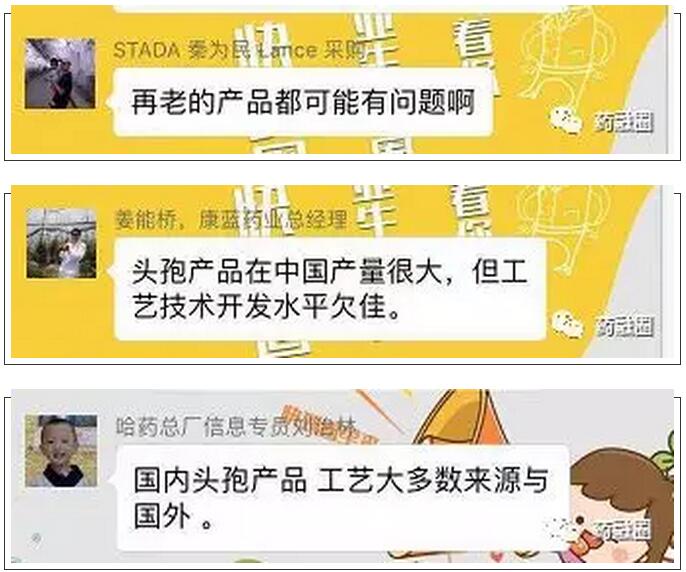
头孢注射剂过不了制剂的一致性评价,是原料药的问题吗?这么老的品种,原料药会有问题吗?
回答:
欢迎关注药融圈官网
看这里:www.pharnex.com
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



