辉瑞“弃子”的传递:借壳上市的Biotech能否在IL-6赛道走出
老牌细胞疗法公司难以为继,
新创Biotech借壳上市
今年6月,纳斯达克上市公司Talaris Therapeutics与生物技术公司Tourmaline Bio宣布达成合并协议,合并后的公司将以Tourmaline Bio为名运营,并在纳斯达克以“TRML”为股票代码进行交易。

值得一提的是,Talaris寻求合并是在公司终止核心管线,大幅裁员之后的“求生”手段。这家细胞疗法公司创立于2002年,2021年在纳斯达克上市,后又因何陷入“濒临解散和清算”的境地?
Talaris公司创立之时名为Regenerex,创始人Suzanne Ildstad博士从事细胞疗法已有数十年,致力于为移植免疫学开发同种异体细胞疗法,让器官移植患者摆脱终身服用免疫抑制药物的需求,Talaris的研究与开发工作便是基于她的研究成果。2013年,该公司就其首款候选疗法FCR001与诺华达成授权合作,进行共同开发。不过在2016年,诺华宣布解散其细胞与基因治疗部门,Regenerex重获FCR001全球权益。2019年,Regenerex更名为Talaris。药融圈旗下药融云数据www.pharnexcloud.com显示,FCR001曾获得FDA授予的孤儿药和再生医学高级疗法称号。
然而,随着FCR001的3期临床试验的开展,阴霾接踵而至。2022年6月,该公司报告3名患者出现了急性移植物抗宿主病(aGvHD)。2022年10月20日,公司宣布其中1名患者死亡,导致该疗法安全性遭受质疑,当天Talaris股价跌去43.39%。2023年2月,Talaris宣布终止FCR001在活体肾移植(LDKT)中的两项3期临床试验,这一决定主要归因于入组的速度和关键里程碑的相关时间表,仅保留一项针对硬皮病患者的2期临床试验(已在3月自愿暂停临床试验登记),同时该公司还决定裁员三分之一,并宣布寻求包括但不限于收购、合并、可能的业务合并和/或剥离公司的细胞治疗CMC能力。4月,Talaris再次宣布裁员,95%的剩余员工被裁去,其中包括大部分高管。如果再寻不到“出路”,董事会可能就要做出解散和清算的决定了。
不过Talaris在对战略方向进行全面审查之后,最终敲定了与Tourmaline Bio合并的方案,双方在6月22日签订了合并协议。截至2023年6月30日,Talaris的累计赤字为2.02亿美元,拥有现金、现金等价物和有价证券共1.523亿美元。(FCR001相关的某些临床数据和知识产权出售给了生物技术公司ImmunoFree,Talaris的商业规模细胞和基因疗法开发和生产设施出售给了New York Blood Center Enterprises)
10月19日,两家公司宣布完成合并,同时Tourmaline Bio还宣布完成了7500万美元的私募融资,投资方包括维梧资本、Deep Track Capital、Braidwell、启明创投、Logos Capital、Great Point Partners、Affinity Asset Advisors、RA Capital等机构。交易完成之后,Tourmaline Bio的现金、现金等价物和投资资产约为2.18亿美元,预计能够支持该公司2026年之前的运营开支。
在行业寒冬之下,遭遇类似困境的biotech不在少数,Talaris Therapeutics的命运令人唏嘘,但最终也算是以另一种方式“存在”下去了。合并完成之后,先前Talaris的股东持有合并后公司约21.9%的股份,新公司董事会7名成员中的2名将由Talaris任命,公司领导团队全部来自Tourmaline Bio。
而Tourmaline Bio则通过对Talaris的反向并购,实现“借壳上市”。在此之前,Tourmaline Bio是一家成立仅两年的公司,2022年才开始正式运营,到今年9月底只有28名员工,药融云数据www.pharnexcloud.com显示,该公司2023年上半年刚完成1.12亿美元的A轮融资,此次合并让Tourmaline Bio绕过IPO,以一种另类的方式登陆资本市场。
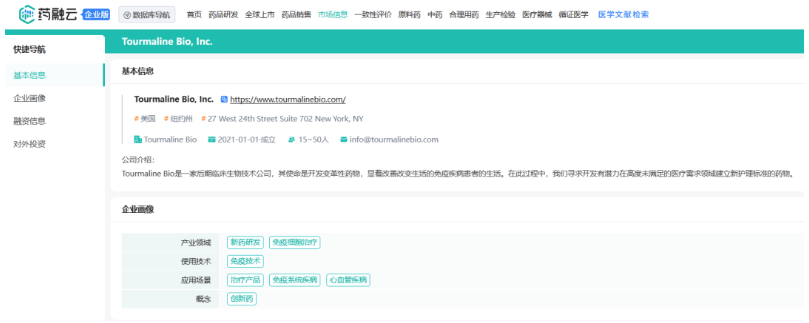
截图自药融云数据库
仅一条管线,引进自辉瑞
Tourmaline Bio由Sandeep Kulkarni博士创立并掌舵,他曾担任Roivant Sciences特殊项目副总裁以及Immunovant的首席运营官(Immunovant在2019年通过SPAC路径上市)。
合并完成后,新的Tourmaline Bio公司致力于在免疫性疾病领域开发变革性药物。目前,该公司仅有一条正在开发的核心管线——抗IL-6抗体TOUR006,药融云数据www.pharnexcloud.com显示,TOUR006最早由辉瑞研发(辉瑞研发代号PF-04236921)。2022年5月,Tourmaline Bio与辉瑞达成协议,获得TOUR006的全球独家开发和商业化权利。
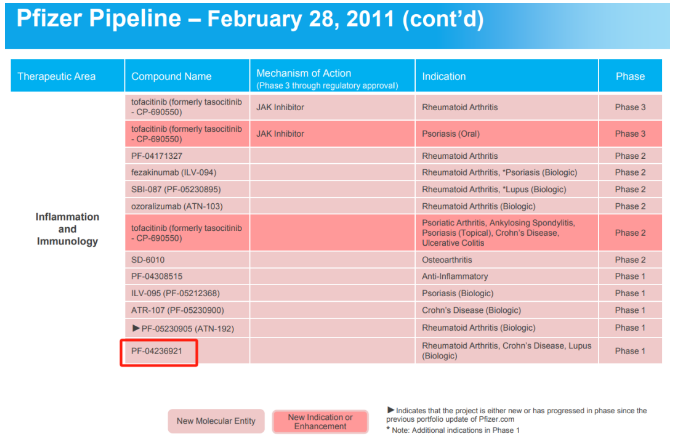
截图自辉瑞2011年2月pipeline,由药融云数据提供线索
针对该项目,辉瑞曾在2010年至2016年间在克罗恩病、狼疮和类风湿性关节炎患者中开展过1期和2期临床试验,后将其视为超出需要的多余项目资产,这使得Tourmaline能够“趁虚而入”。当时辉瑞对于该药的开发重点与赛诺菲/再生元和罗氏(Roche)等其他IL-6药物开发商的重点相重合,且赛诺菲/再生元的Kevzara(Sarilumab)已在2017年获批,而罗氏的Actemra(托珠单抗)早在2010年获得FDA批准,适应症包括类风湿性关节炎等。
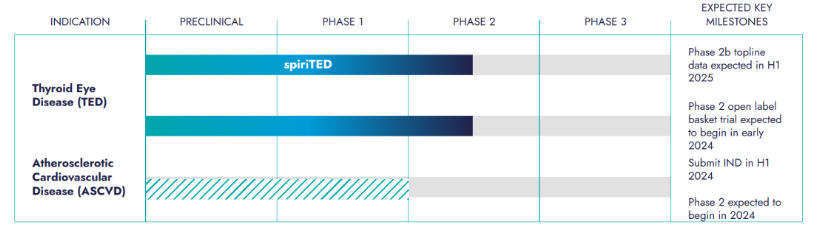
因此,Tourmaline将TOUR006引入了一条不同的道路——以炎症和自身抗体为特征的疾病,在这类疾病中IL-6通路抑制剂展现出令人信服的临床获益信号,但尚未得到充分开发。Tourmaline由此为TOUR006制定了两方面的临床开发计划:一方面是TED(甲状腺眼病,又称格雷夫斯眼病),IL-6药物已在该病作为超说明书用药使用;另一方面是ASCVD(动脉粥样硬化性心血管病),这类疾病与IL-6通路的联系具有临床和遗传学数据的支撑。
根据企业公开资料,该抗体由Medarex转基因小鼠平台生成(Medarex是最早开发“O药”和“Y药”的抗体药物鼻祖,后被BMS收购)。Tourmaline认为TOUR006具有良好的抗IL-6抗体特性,具有与IL-6的高结合亲和力(KD值6pM)和长半衰期(终末半衰期47-58天),可以以相对较低的药物暴露量实现对IL-6信号通路的深度抑制,从而可以设计为小剂量、皮下递送给药,并实现低频注射,这也是TOUR006与现有IL-6/IL-6R抑制剂相比的潜在优势。
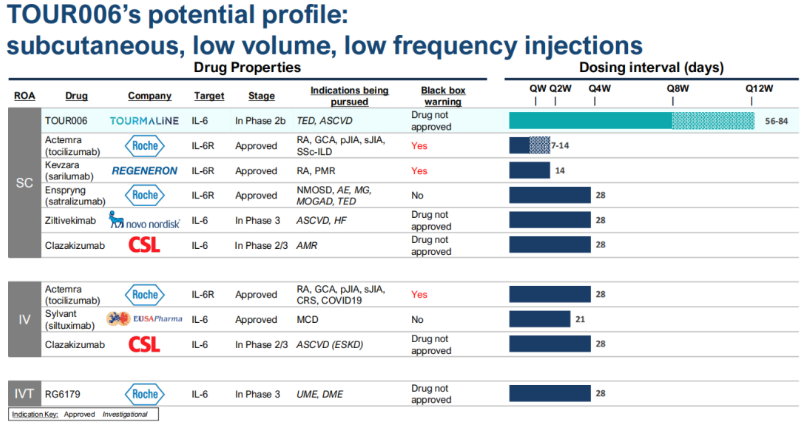
潜在最佳的TED一线治疗方案
甲状腺眼病(TED)又称格雷夫斯眼病,是一种影响眼睛及其周围组织的自身免疫性疾病,其特征是自身抗体介导的眼部周围组织的激活,导致炎症和毁容,严重时可危及视力。在美国,每年约有3万例TED新发病例,约2/3的患者被诊断为中度至重度。TED分为两个阶段:初始的活动期,其特征是持续6-36个月的高炎症期,以及后期的非活动期,炎症受累程度较低,主要病理改变是纤维化。
TED的病理生理学由针对促甲状腺激素受体(TSHR)的自身抗体驱动,这些抗体靶向眼睛周围的组织,导致炎症、肿胀和组织重塑。IL-6被认为在TED发病机制中起关键作用,包括在自身抗体的产生、T细胞介导的炎症,以及眼眶成纤维细胞活性。Tourmaline确认大量已发表的临床观察结果表明,抗IL-6R单克隆抗体Actemra®(托珠单抗)在该病的超说明书用药有助于减少患者的炎症、眼球凸出和自身抗体水平。不过目前为止,尚未有一个正式的、业界赞助的开发工作,研究IL-6通路抑制剂治疗TED。
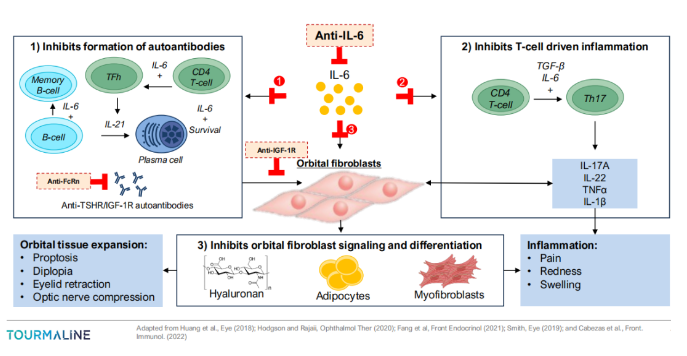
此前,虽然美国FDA已批准了Horizon Therapeutics(该公司已被安进以278亿美元收购)的IGF-1R(胰岛素样生长因子-1受体)抗体Tepezza(teprotumumab-trbw)用于治疗TED,但是绝大多数中至重度的患者(80%)仍未得到治疗,或在接受治疗时疾病已处于相对较晚阶段。2023年7月,FDA标签更新提示Tepezza可能会导致严重的听力障碍包括听力损失,在某些情况下可能是永久性的。同时,Tepezza治疗患者在长期随访中,观察到复发率很高,且每隔三周就需要静脉给药,给治疗带来不便。(这些因素也可能是Tepezza近两年销售表现不佳的原因)
Tourmaline已经确定甲状腺眼病(TED)作为TOUR006的主要适应症,并认为该IL-6抗体拥有广泛、深刻、持久的药效,良好的安全性,对医生和患者友好的给药方式(皮下注射、低剂量、每8周一次)等优点,有潜力成为最佳的一线TED治疗方案。同时,TOUR006寻求早期干预,阻止以炎症为特征的活动期阶段的疾病进展,从而改善患者预后。

2023年8月,美国FDA批准了一项TOUR006用于一线治疗TED的IND申请,该研究是一项双盲的、安慰剂对照的关键2b期临床试验,已在2023年Q3启动。预计将在2025年上半年获得主要2b期数据。
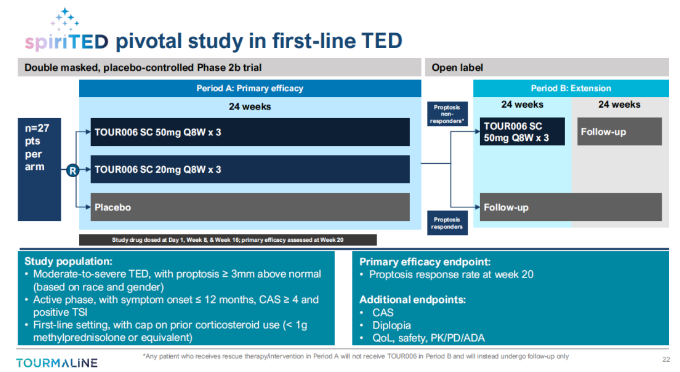
此外,Tourmaline计划发起一项在其他TED患者队列中进行的开放标签篮式研究,以进一步了解TOUR006在更多TED亚组中的治疗效果,预计将在2024年初启动。
潜在差异化的ASCVD抗体疗法
TOUR006的第二个适应症是动脉粥样硬化性心血管疾病(ASCVD)。ASCVD是由动脉壁斑块积聚和破裂引起的一类疾病,包括心肌梗塞(心脏病发作)和中风。尽管现在已有每日口服药物如降血脂疗法、抗高血压药物和抗血小板药物,心血管疾病仍然是全球头号死因,每年导致约2000万人死亡,因此依然存在大量的未满足需求。
当前ASCVD的治疗重点是通过减少危险因素来预防重大心血管不良事件,但炎症仍未得到解决。二十多年来,炎症和IL-6在ASCVD发病机制中的作用一直是研究的重点。非临床研究表明IL-6与斑块形成、侵蚀和破裂有关。心血管系统内皮细胞在炎症、应激和/或损伤时表达IL-6。此外,IL-6已被证明具有上调细胞粘附分子的能力,并在血管通透性中发挥作用。多项临床和人类遗传学研究表明,IL-6水平升高与未来发生重大心血管不良事件的风险有关。在多项心血管研究中,炎症的减少与治疗结果的改善有关,并且是治疗获益的有力预测指标。
Tourmaline认为TOUR006能够通过每三个月一次的皮下注射给药,以潜在的差异化形象进入市场。该公司计划在2024年上半年提交IND申请,以支持TOUR006针对ASCVD的2期临床研究的启动,预计将在2025年准备3期临床试验。此外,公司计划为TOUR006寻找更多的机会。

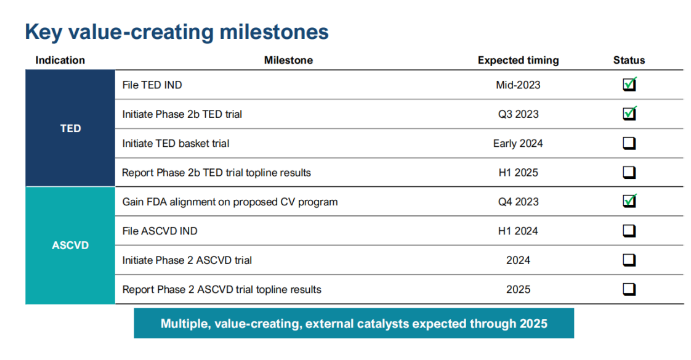
下图为Tourmaline公司预期里程碑:
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);
https://www.tourmalinebio.com/;
https://louisville.edu/bucksforbrains/faculty/ildstad;
https://www.fiercebiotech.com/biotech/tourmaline-rocks-nasdaq-inking-talaris-reverse-merger-fund-midphase-trials-ex-pfizer-drug;
https://www.prnewswire.com/news-releases/immunofree-inc-has-acquired-talaris-therapeutics-incs-tolerance-business-301900001.html;
https://www.globenewswire.com/news-release/2023/10/19/2763751/0/en/Tourmaline-Bio-Announces-Closing-of-Merger-with-Talaris-Therapeutics-and-Concurrent-Private-Placement-of-75-Million.html;等等
<END>
下一篇:最后一页
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



