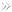 您现在的位置:新闻中心 > 药融新闻 > 正文
您现在的位置:新闻中心 > 药融新闻 > 正文
国产新药,CD20抗体正式商业化上市
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
药融云数据,www.pharnexcloud.com显示:2022年8月23日,神州细胞工程有限公司(以下简称“神州细胞”)的新型抗CD20单抗瑞帕妥单抗(Ripertamab)获得国家药品监督管理局(NMPA)正式批准上市。安平希®—瑞帕妥单抗是神州细胞自主研发,结构优化、安全升级的新型抗CD20单抗。适用于国际预后指数(IPI)为0~2分的新诊断CD20(Cluster of Differentiation 20)阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)成人患者,应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)联合治疗。相比于进口利妥昔单抗相同的疗效,安平希安全性趋势更优,可显著降低间质性肺病和肺部炎症不良反应的发生率。
淋巴瘤是最早发现的血液系统肿瘤之一,是发病率最高的血液肿瘤,且发病率逐年升高。据最新GBD(全球疾病负担)数据分析显示,2019年中国淋巴瘤新发病例数达10万例,估算中国淋巴瘤患病人数达47万例,中国淋巴瘤疾病负担呈上升趋势。弥漫大B细胞淋巴瘤是可治愈的淋巴瘤,占中国B细胞淋巴瘤约50%。抗CD20单抗是B细胞淋巴瘤治疗的基石药物。
安平希®是结构优化、安全升级的新型抗CD20单抗,是我国最早研制的抗CD20抗体药物之一,于2016年进入临床Ⅲ期试验,2019年完成临床Ⅲ期试验研究。(分为500mg(50ml)/瓶 ;100mg(10ml)/瓶 规格)
临床试验研究结果显示,
疗效显著:安平希®疗效不劣于进口利妥昔单抗,符合方案分析集结果显示,安平希®和利妥昔单抗组ORR(客观缓解率)分别为94.5%VS94.1%,疗效非劣效性成立。
安全性好:安平希®和利妥昔单抗组不良事件发生率没有显著差异,整体安全性相似。安平希®组≥3级不良输注反应发生率更低(0.8%VS1.7%),ADA(治疗后与研究药物相关的抗药性抗体)阳性率更低(10.9%VS16%),间质性肺病不良反应发生率显著降低(2.9%VS9.1%,P=0.01),肺部炎症不良反应发生率显著降低(9.1%VS19%,P=0.0067)。
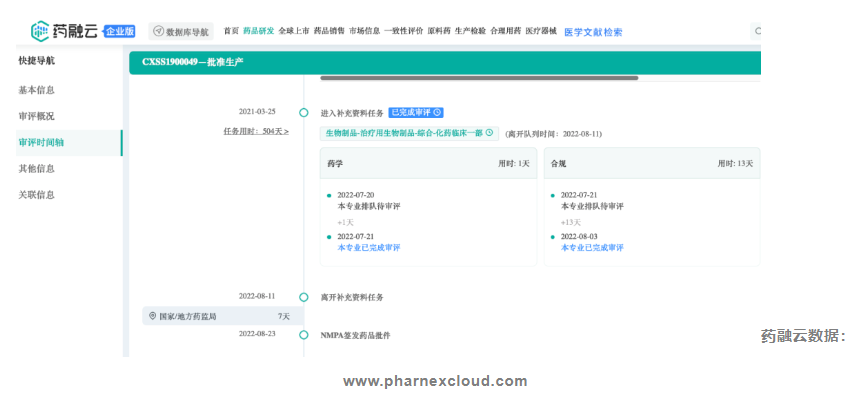
安平希®采用人抗体天然序列,在重链CH1恒定区219位点采用的是缬氨酸,为主流序列。该氨基酸序列更广泛地应用于已上市抗体,包括13个已上市的IgG1-G1m17,1型抗体和12个IgG1-G1m17和G1m3型抗体。奥妥珠单抗、奥法木单抗和阿达木单抗与安平希®在重链恒定区序列完全一致。
关键注册III期临床试验线上发表于《Hematological Oncology》杂志 (IF=4.850) ,该研究比较了瑞帕妥单抗与原研利妥昔单抗联合CHOP治疗初治弥漫大B淋巴瘤(DLBCL)的疗效和安全性。
安平希®的研发和上市,是神州细胞继重组人凝血因子Ⅷ—安佳因®上市后第二款上市的生物药,是在生物制药研发方面又一里程碑式的突破。神州细胞发布2022年半年度业绩报告:销售收入大幅攀升,创新驱动效果显著。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据:www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
Yuankai Shi, Qingyuan Zhang, Xiaonan Hong, et al . Hematol Oncol. 2022 Jul 20;
Sung H, Ferlay J, Siegel RL, et al. CA Cancer J Clin, 2021, 71(3):209-249;
Lancet. 2018; 391(10125): 1023-1075;
李小秋等, 诊断学理论与实践, 2012, 11 (2): 111-115;等等。




 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



