抗体药物生产的“加速器”
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需得到授权。
近年来,生物医药领域增长迅速,其中抗体药物由于其特异性、高效性和安全性等特点,已被广泛应用在在恶性肿瘤、自身免疫性疾病、新冠肺炎等重大疾病中,并成为国际制药业竞争的焦点。
不同于合成药物,抗体药物的生产主要利用的是哺乳动物细胞表达系统,其中中国仓鼠卵巢(CHO)细胞是重组蛋白生产的首要选择。整个生产过程如图1所示,大体分为四个部分:
-
细胞表达抗体
-
收集上清液
-
分离纯化抗体蛋白
-
药物产品制剂化
其中,抗体的细胞表达水平随着抗体工程技术的发展得到了显著提高,大大降低了规模化细胞培养的成本。
然而,生物料液的复杂性及对抗体产品要求的严格性使抗体纯化等下游加工环节成为了抗体生产的关键,约占抗体生产成本的50%~80%。

图1 抗体药物生产的简要流程图
现阶段对于下游加工环节的关注点主要集中在两个方面:料液预处理和抗体纯化。
高活细胞密度生产高滴度抗体蛋白的工艺会产生更高浓度的固体颗粒和亚微米级的细胞碎片。传统的离心工艺很难将其除去,最终会导致微滤系统或下游的收获过滤系统结垢,过滤效率大打折扣,并且会造成产品的损失。
抗体纯化阶段使用最广泛的是亲和层析技术。它对生物分子选择性的吸附和分离,可以取得很好的纯化结果。但由于载体较昂贵,配基与载体耦联条件激烈等缺点使其应用于大规模抗体生产中存在诸多困难。
鉴于此,絮凝技术和沉淀技术被开发应用于抗体生产中,以期望能解决上述难题。
絮凝技术是利用细胞和细胞碎片在细胞培养液中带有轻微的负电荷,因此可以利用聚阳离子聚合物结合带负电荷的细胞和细胞碎片,形成较大的颗粒。这些颗粒很容易发生自身沉降,从而使得上清液具有更高的过滤速率以及更低的产品损耗[1]。
沉淀技术是利用聚乙二醇、金属离子等试剂使溶液中的抗体蛋白形成蛋白簇,随后利用切向流过滤技术对抗体蛋白进行过滤回收,最终在产量和纯度方面可以获得与亲和层析色谱相似的结果。这体现出沉淀技术具有高度的竞争力[2]。
在上述的两种技术中,形成的颗粒尺寸大小和分布对于工艺而言是重要的优化因素。因此,引入实时颗粒分析系统优化工艺条件,提高生产效率并降低生产成本是必要的。
梅特勒托利多的实时颗粒分析仪器(图2)——ParticleTrack G400(聚焦光束反射测量技术(FBRM))和EasyViewer 100(在线颗粒成像分析技术)可以帮助研究人员实时动态监测颗粒生成过程,从而理解过程参数对颗粒性质的影响。两者在单抗生产中的安装方式如图1所示。

图2 梅特勒托利多在线分析仪器——ParticleTrackG400(左图)、EasyViewer100(右图)
近年来,有学者借助这些先进的仪器进行了相关的研究并进行了报道。
絮凝剂在与细胞碎片等发生絮凝时形成的颗粒大小和尺寸分布会受到絮凝剂种类与添加策略等因素的影响,进而对过滤效率造成影响。
安进公司纯化工艺开发部门[3]开发了一种新颖且简单的双聚合物絮凝方法,用于从高细胞密度的细胞培养过程中收获单克隆抗体。在实验中,研究人员利用ParticleTrack G400来监测体系中不同絮凝剂加入后颗粒数量和大小的变化情况,从而判断絮凝策略的有效性。
结果显示,在只加入聚阳离子聚合物聚二烯丙基二甲基氯化铵(PDADMAC)后,体系中小于10微米的颗粒数从88增加到28117个颗粒/秒,提升了两个数量级之多。
从中可以看出,体系中包含了很多低于仪器检测限0.5微米的颗粒,PDADMAC可以将这些亚微米细胞碎片颗粒絮凝,形成更大的、更易检测的絮凝颗粒,去除这些亚微米颗粒可以将膜过滤通量提高至少6倍,显著改善了深度过滤的效率,这表明絮凝策略的有效性。
此外,根据Stokes定律,由于沉降速度与颗粒大小的二次方成正比,因此提高絮凝颗粒大小是一种有效的策略。研究人员利用仪器对比了单絮凝剂和双聚合物的絮凝效果,结果显示絮凝颗粒的大小从25微米增大至87微米,从而进一步提升了上清液过滤的效率。
利用试剂沉淀上清液中的抗体蛋白时,试剂的种类,添加策略、溶液的pH等对于沉淀结果都有着不小的影响。
诺华塞公司药物创新部门[4]利用PEG6000进行沉淀纯化抗体蛋白时,发现不同的添加策略会形成不同粒度分布的蛋白簇,这会直接影响下一步切向流过滤的效率。研究人员利用ParticleTrack G400探索了不同的滴加模式和时间对形成的抗体蛋白粒度分布的影响。
从图3中可以看出,与3、5或15分钟的添加时间相比,单次添加20%PEG的弦长分布范围更大,这意味着下一步的过滤步骤需要同时处理大颗粒和小颗粒,这对于追求效率的工艺步骤而言显然是不能接受的。
更长添加时间的策略可以控制生长并限制颗粒成核,从而获得所需尺寸和尺寸分布,以增加固液分离的效率。这将最大限度地减少过滤过程中的困难,因为过滤膜的孔径可以更好针对窄粒度分布,以此对过滤速率进行优化。
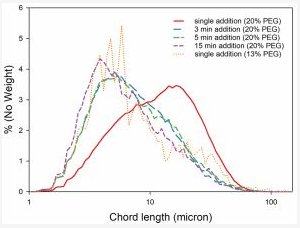
图3 mAb1在不同PEG6000添加时间下粒径分布图
除了添加策略对沉淀蛋白有影响,体系pH值同样发挥着不可忽略的作用。
维也纳农业大学研究人员[5]利用ZnCl2作为沉淀试剂配合切向流过滤回收沉淀蛋白时发现,金属离子沉淀蛋白的过程中,产率和蛋白颗粒粒度分布很容易受到溶液pH值的影响。为了量化pH值的影响,研究人员在12mM ZnCl2的条件下改变pH值进行沉淀实验,其中利用ParticleTrack G400监测生产的蛋白颗粒粒度分布情况。
产率结果如图4A所示,蛋白颗粒粒径分布如图4B-D所示。从结果中可以看出,对于所有重组抗体,沉淀的最佳pH值约为pH6和7,其中最特殊的情况是地诺单抗,仅在pH7时具有较高的沉淀产率。粒径分布受pH的影响和产率类似,在产生较大粒径分布的pH条件也是具有更好产量的条件。
因此,在工业生产中,这意味着ParticleTrack G400在线监测可用于估算所得产率,而无需离线测量沉淀期间的实际浓度。
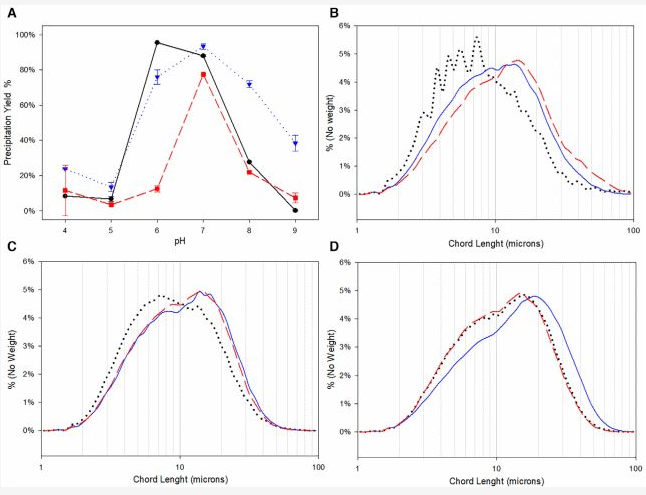
图4 (A)不同抗体在不同pH值下的沉淀产率。黑色圆圈阿达木单抗、蓝色三角形曲妥珠单抗和红色方块地诺单抗。(B-C-D)阿达木单抗、曲妥珠单抗和地诺单抗的粒径分布图。黑色虚线pH8、蓝色实线pH7和红色虚线pH6。
综上所述,细小的细胞碎片颗粒物和昂贵的色谱层析纯化方法是抗体药物的大规模生产的两大痛点。梅特勒托利多的实时颗粒分析系统能够帮助企业追踪各因素对絮凝技术和沉淀技术中颗粒的变化影响,进而可以快速优化工艺,节省下游生产成本,实现高效稳定的抗体药物生产。

扫码获取实时颗粒分析资料
References
[1] Burgstaller D, Krepper W, Haas J, et al. Continuous cellflocculation for recombinant antibody harvesting[J]. Journal ofChemical Technology & Biotechnology, 2018.
[2] Sommer R, Tscheliessnig A, Satzer P, et al. Capture andintermediate purification of recombinant antibodies with combinedprecipitation methods[J]. Biochemical Engineering Journal, 2015, 93: 200-211.
[3] Mcnerney T, Thomas A, Senczuk A, et al. PDADMAC flocculation ofChinese hamster ovary cells: Enabling a centrifuge-less harvestprocess for monoclonal antibodies[J]. Mabs, 2015, 7(2).
[4] Royo M, Beulay J L, Valery E, et al. Mode and dosage time inpolyethylene glycol precipitation process influences proteinprecipitate size and filterability[J]. Process Biochemistry, 2022, 114: 77-85.
[5] Dutra G, Komuczki D, Jungbauer A, et al. Continuous capture ofrecombinant antibodies by ZnCl2 precipitation without polyethyleneglycol[J]. Engineering in Life Sciences, 2020.
<END>
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



