中国医药实施MAH制度,迎来新药研发创新的春天
导读
2015年11月,第十二届全国人大常委会第十七次会议通过《全国人民代表大会常务委员会关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,标志着我国药品上市许可持有人制度(以下称MAH)开始建立。作为药品管理制度改革的核心,持有人制度将对我国药品管理制度创新产生基础性、全局性和战略性的影响。
医药信息开发、研如玉:
两个微信公众号属于医药信息开发、交流群超级QQ群。超级QQ群2012年建立以来已将发展成为拥有3700名实名业内同行在一起交流的一个免费的公益性的研发圈子。在国药励展赞助下已经举行了八季群友学术沙龙。第九季预计在11月中旬厦门API会上举行。
创始者VIP熊孩子哈药总厂科研开发中心,从业23年的研发人员。在哈药总厂从事过发酵,新产品开发立项、合成、产业化推广、酶工程等多个岗位从事过研发和生产工作。
金黄的落叶堆满心间,而我已经不是翩跹少年!
这是这些年的一些感触。今天向大家介绍的是MAH相关知识。
序号
一
什么是MAH?
定义
所谓药品上市许可持有人制度是指药品批准文号的持有人,包括药品生产企业、研发机构和科研人员,以自己的名义将药品推向市场,并对药品全生命周期承担相应责任的一种制度,是当今国际社会普遍实行的药品管理制度。该制度的核心就是鼓励药品研发创新,调动各方面的积极性。同时,这项制度也可避免企业大而全、小而全,抑制低水平重复建设。药品上市许可持有人制度(Marketing Authorization Holder,MAH)是指将上市许可与生产许可分离的管理模式。这种机制下,上市许可和生产许可相互独立,上市许可持有人可以将产品委托给不同的生产商生产,药品的安全性、有效性和质量可控性均由上市许可人对公众负责。
关键点
CFDA的网站可以看到2016年6月网站发布了杨悦博士的文章《药品上市许可持有人制度试点方案》关键点评析。文章还列举了试点方案。
关键点包括:
第一,改变药品批准文号与生产企业捆绑的模式;
第二,上市许可持有人资质依申请获得;
第三,允许跨试点区域委托生产;
第四,简化技术转让与受托生产企业审批;
第五,试点范围涉及面广,涵盖了化学药品、中药和生物制品;
第六,申请人、持有人与药品生产企业责任明晰;
第七,药品上市后监督管理措施有力。
之后网站对政策解读也发表了三篇连载,包括制度试点的积极意义,主要是改变我们目前药品注册和生产许可“捆绑”的模式,鼓励创新,保障药品供应,调整产业结构,合理配置资源,最终助力于“十三五”的提高产业集中度的目标的实现。药品上市许可持有人制度是采用药品上市许可与生产许可分离的管理模式,即允许药品上市许可持有人(药品生产企业、研发机构或者科研人员)自行生产药品,也可委托一家或多家生产企业共同生产药品,避免了因市场需求量增大导致药品的短缺,同时强化了持有人的主体责任,为药品质量提供了保证。持有人制度为我国现行上市许可与生产许可“捆绑制”的管理模式松绑,解除药品注册制度对我国药品行业发展的制约。
药品上市许可持有人制度的实施,将是医药行业的一次‘产权革命’。能够提高药品研发机构和科研人员创新积极性,促进医药产业供给侧改革,提升产品质量,抑制低水平生产企业重复建设。那我们开始看看这个方案是如何来的?
序号
二
MAH实施的时间和系列文件要求
自2007版《药品注册管理办法》颁布之后没几年,业界就不断有建立药品上市许可人制度的呼声,直指药品注册弊端:
1、研发积极性不足(“卖青苗”现象相当普遍)
2、重复建设现象严重(GMP改造投资得不到及时回报)
3、审批资源遭遇浪费(重复申报文号的现象十分突出)
4、研发机构安全意识弱(技术研发者因已经将其技术转让而对药品上市后的任何问题不负责任)
5、消费者权益难以保障(以协议形式进行技术转让后出现的药品安全问题,难以得到切实、有效的法律防范)
事实上,早在2009年原国家食品药品管理局注册公司就曾启动过有关中国药品上市许可人制度的研究。当时不少监管一线的人士担心,“捆绑”式管理尚不能保证药品质量,如果将二者分离,有可能会使制药行业涌现出更多不具备能力的“临时工”,不利于保障药品安全。因此虽然在药品上市许可制度改革是大势所趋这个观点上达成了共识,但政策层面却未有动作。
业内呼吁了十年,MAH姗姗来迟,不过毕竟是来了!
2013年两会上,全国政协委员冯丹龙在题为《我国实施药品上市许可持有人(MAH)制度的建议》的提案中,2013年12月23日,《药品管理法》启动修订;2014年4月由国家食药监总局局长张勇为组长的修订工作领导小组将会综合国家食药监总局、中国药科大学和清华大学法学院分别起草的三份初稿意见,形成最终版的《药品管理法》修订草案,药品上市许可制度的改革或将写入修订草案,是本次《药品管理法》修订的一个重要看点。引进药品上市许可人(MAH)制度的呼声也持续高涨。2015年4月24日,新修订《药品管理法》日通过并施行,但药品上市许可制度未按预期写入。
2015年7月以来,药品审评审批改革集中开展,8月18日举行新闻发布会上CFDA副局长吴浈肯定了药品持有人制度。从2015年开始,这个实施节奏开始提速。2015年10月30日,CFDA局长毕井泉向全国人大常委会作了《关于授权国务院开展药品上市许可持有人制度试点和药品注册分类改革试点工作的决定(草案)》的说明。
2015年11月4日,十二届全国人大常委会第十七次会议授权国务院在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川十省市,开展为期三年的药品上市许可持有人制度试点。
这段时间,密集的政策开始出台。
1、2016年6月6日,国务院办公厅发布《关于印发药品上市许可持有人制度试点方案的通知》,明确了试点内容、试点药品范围、申请人和持有人条件、受托生产企业条件,上市许可持有人试点正式落地。
2、2016年6月-2017年1月,CFDA发布《药品上市许可持有人制度试点方案》政策解读三篇。期间,各省市试点实施方案陆续出台。
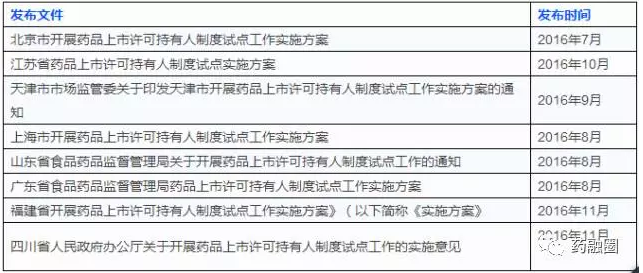
各试点省市陆续发布各自MAH相关文件
3、2016年12月27日,齐鲁制药宣布其研发的吉非替尼首仿药经CFDA批准取得上市许可持有人文号,这是我国首个药品上市许可持有人制度试点品种。
4、2017年1月6日,CFDA公布药品上市许可持有人试点品种申报情况。截至2016年12月25日,CFDA 共受理试点省市165份药品上市许可持有人注册申请。
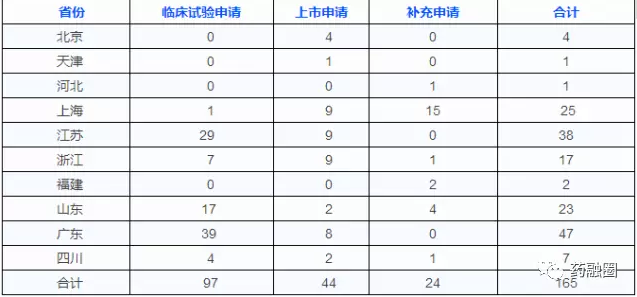
药品上市许可持有人试点品种申报情况表
(数据来源CFDA)
序号
三
MAH在试点城市的实施情况
1、2017年3月27日,浙江医药股份有限公司的苹果酸奈诺沙星原料药及其胶囊剂(商品名太捷信)经国家食品药品监督管理总局(CFDA)批准取得了药品上市许可持有人文号,这是我国药品上市许可持有人制度试点实施以来,获益的首个创新药。
2、广州白云山医药集团股份有限公司下属子公司广州白云山奇星药业有限公司收到国家食品药品监管总局核准签发的华佗再造丸等75个品种的《药品补充申请批件》,成为这75个品种的上市许可持有人(MAH)。这75个在2015年末因厂址整体搬迁而停产的品种,因MAH制度试点将重获新生。
他们是受益者,当然这对研发机构的要求很高,研发能力是第一位的,持有人对产品有持续研发的责任;管理能力的重要性排第二,持有人要有管控生产、流通的能力;另外还要有责任承担能力,要能获得银行、保险公司或合作伙伴的担保。到目前为止现在还都是研发机构或者企业。暂时没有出现研发人员个人申请成为MAH的成功先例。
序号
四
MAH的主体资格以及主要权利
主体资格
在研究申请人、持有人的资质或者条件时,需要考虑一个重要前提,即由于继承、收购、兼并和转让等原因,申请人、持有人在申请过程中和产品获得上市许可后可以进行变更,这是药品生产要素自由流动的需要。目前,我国试点方案仅允许科研单位、研发人员、生产企业成为持有人,把制度更多定位在鼓励药物创新方面。在研究持有人制度时,有关申请人、持有人的条件,应当考虑以下三个方面:
一是研制能力。这是成为申请人、持有人的首要条件。研制能力,也就是技术能力、创新能力。申请人能否最终成为持有人,主要取决于其申请的药品是否具有安全性、有效性和质量可控性。
二是管理能力。由于申请人和持有人的可分离性,以及药品生产技术的可转移性,对申请人和持有人的管理能力的要求是不同的。管理能力包括多方面的内容,如药物临床试验管理能力、样品试制管理能力、药品生产经营管理能力等。作为申请人和持有人,其应当具备药物临床试验管理能力和样品试制管理能力。作为持有人,如果其自己进行生产或者委托他人生产,其还应当具备生产经营管理能力。
三是责任能力。严格来讲,责任能力包括管理能力和赔偿能力。这里主要论及赔偿能力。这里需要回答五个方面的问题:一是何为赔偿能力?所谓赔偿能力,一般是指药品研制、生产、经营活动给他人造成损害时,申请人、持有人所承担的经济赔偿能力。二是何人具有赔偿能力?在研究哪些主体具有赔偿能力时,多数人除了对法人单位的赔偿能力没有疑虑外,对非法人组织和自然人的赔偿能力普遍担忧。从“偶然所有权”概念出发,并不是法人单位的赔偿能力就一定比非法人单位的赔偿能力强。三是赔偿能力源于哪里?是必须以其自有的财产作为赔偿的基础,还是可以通过购买保险或者其他担保方式进行赔偿?四是何时需要具有赔偿能力。是药品注册时需要申请人、持有人具有赔偿能力,还是药品生产时需要具有赔偿能力?在这个“时间差”中,申请人、持有人的赔偿能力是否会发生变化?五是在行政管理制度设计中是否需要规定这一民事事项?政府是否对持有人的民事赔偿义务承担一定的管理责任。该制度设计的法律价值取向是什么?这些问题实际上都涉及监管的一些深层次问题。
实际上,从研发能力、管理能力到责任能力,这是对申请人、持有人资质条件的递进管理要求。在这里,需要从药品质量的全生命周期管理进行时空安排,而不应局限于药品上市许可环节。
主要权利
一是具有转让的权利。持有人是否可以将上市许可证明文件进行转让,这是一个长期引人争论的话题。从理论上讲,上市许可证明文件是含有财产权和人身权双重属性的权利,这是研判这一问题的关键。从财产权属性出发,上市许可证明文件是可以转让的。从人身权属性或者行政管理属性出发,上市许可证明文件的转让则需要履行一定的程序。上市许可证明文件的转让应当由法律、法规作出明确规定。
二是具有委托的权利。持有人制度的最大亮点是上市许可持有人可以不再与药品生产企业捆绑。由此持有人的经营活动有三条路径可以选择:自己建厂生产和销售、委托其他企业生产和销售、转让上市许可证明文件。委托其他企业生产和销售药品,持有人可以在不增加厂房设施和人员的情况下,迅速扩大产能并占领市场,这对于遏制低水平重复建设具有十分重要的意义。持有人与生产经营企业之间的关系,属于委托关系。这种委托关系,哪些内容纳入法律调整,哪些由协议规定,需要认真研究。
三是监督的权利和义务。持有人委托企业生产和销售药品时,持有人有对受托企业的生产和销售行为进行监督的权利。同时,监督也是委托人即持有人的一项基本义务。这符合委托法律关系的基本原理。监督包括哪些内容,需要深入研究。受托企业的生产经营活动是否符合药品生产经营的要求,是否符合生产经营质量管理规范的要求,以及是否符合委托协议的要求,都应纳入监督范围。
序号
五
MAH试点结束后,我们该怎么办?
目前已有多地出台本地试点实施方案,但基本都是鼓励企业能够在本地企业之间进行互相转让或委托。如果到了试点结束,但产品还没有获批怎么办?申请人和持有人、受托生产企业各自须具备什么样的条件?如何确保持有人具备药品质量安全责任承担能力?
这些问题仍需在实践中予以探索解决,并进一步明确。
1月9日,经李克强总理签批,国务院正式印发《“十三五”深化医药卫生体制改革规划》(以下简称《规划》),建立规范有序的药品供应保障体系是规划的五大重点之一。“加快推进仿制药质量和疗效一致性评价,鼓励创制新药,鼓励以临床价值为导向的药物创新”、“建立药品上市许可持有人制度”等内容在规划中再次被强调指出。
这个政策的实施实际上对研发人员和机构提出了更高的要求。也让研发机构焕发了新的活力赢得新时代的机会。
“新药研发创新的春天来到了,将是一轮新的洗牌”。医药大咖们纷纷感叹。
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



