药智网联合创始人李天泉|医药新政后的中国医药研发新趋势

药融圈第134场专享会嘉宾:药智网联合创始人 李天泉

我长期从事医药行业的研发,承担多项国家和省级研发项目,获得国家发明专利5项,担任多年新药研发负责人,成功开发出数十个新产品。近年来醉心于医药数据库的建设与利用,联合创办了专业的中国领先的医药大数据服务平台---药智网,精于医药信息的检索与利用,擅长通过专业数据的挖掘来解读行业政策、医药热点信息,深入分析医药行业发展现状与趋势、帮助企业决策、助力药企业研发。
本次主要和大家分享医药新政后的中国医药研发新趋势的相关内容。下面就以下几方面的问题和大家进行深入解读。2016年以来CFDA密集出台,化药注册分类改革等诸多新政实施展以来。企业界如何应对?研发方向发生了什么样的深刻改变?有什么需要关注的热点?
纲要:
1. 政策变化与研发项目选择的关系
2. 医药新政后的投资、研发趋势分析
3. 注册分类改革后的化学药研发申报趋势
政策变化与解读
这次主要从以下三个方面来为大家做介绍。我们都知道从2016年以来,国家的医药政策发生了很多的改变,特别是医药研发方面,可以说发生了一个翻天覆地的变化。那么政策实行这么多年到底有什么样的变化?政策变化之后呈现什么样不同的反应有哪些数据呢?
下面这张图是我统计的从2005年到现在,每一年申报的药品品种数量,包括中药化药和生物药。从这张图我们可以看到在2004至2005年有一个高峰期,那时候每年的申报数量非常多。申报新药也非常愉快,基本上报一个批准一个,但是到了2007年进入药品注册核查的时候,就查得非常严格。我们国家的药品研发非常大 ,在2007年进入低谷之后,药品研发开始逐步回升。直到2016年,我们才知道有所谓的722惨案,就是药品临床注册实验核查。这才发现原来我们做这么多年临床实验的不真实、不规范。2016年之后又把企业打回原形,药品研发、申报数量快速下滑,好在2017年2018年开始逐步回升。
国家的医药行业也是一个政策式的形式,就好比股市。发展申报数量的多少,不是平稳的一条线,而是由波峰波谷组成,伴随着政策起伏。所以做医药行业首先需要研究好政策,今天给大家看的是2016年医药新政注册临床试验核查之后,所反映出的一些数据变化。

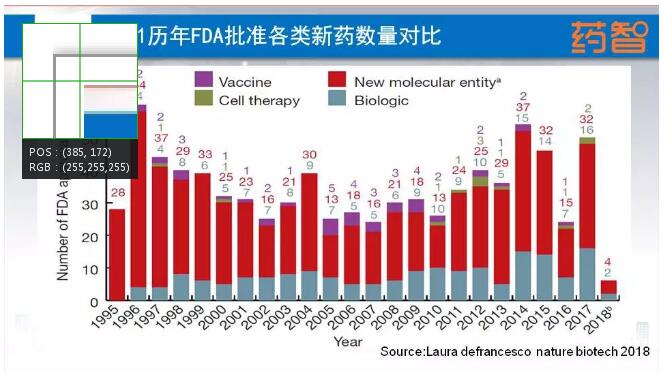
下图统计的是美国这十多年的新药申报数量,总体来看申报数量还是比较平稳。需要注意的就是蓝色部分是一些生物药,生物药也分疫苗以及细胞治疗,生物类药品发展比较快速。其实也能看出我们国内情况也是一样的,生物医药的发展比较快。包括这次722核查,临床新政并没有影响到生物药的申报激情。中药从20017年注册核查以来一直一蹶不振,中药是过去式,化药是现在式,生物药是未来式。
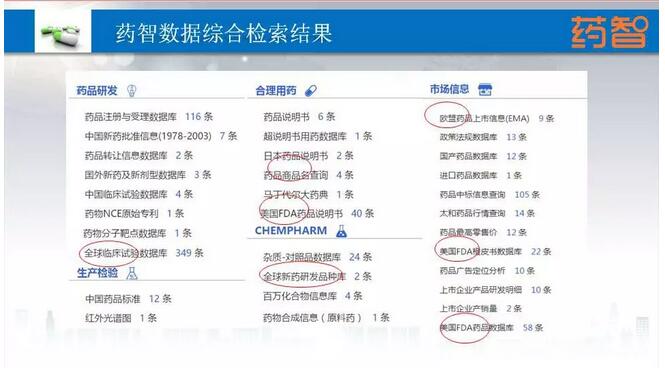
国家药监局药审中心每周都在出一些新的政策,药智网政策法规数据库把这些政策法规都收集在一块儿,也包括FDA以及欧盟政策法规。大家可以做标题检索和全文检索,去检索相关的政策法规。

对于仿制药方面,通过仿制药一致性评价也好,申报仿制药也好,应该说研发的要求和标准是大大提高了。基本上是国际接轨的一个态势。以前我国的仿制药并不能替代原研药,但是通过这次的改革我们要做的就是仿制药来替代原药。从质量上来提高,也从市场上来替代。

国家这几年医药新政改革方向,实际上我觉得是走的国际化道路,特别是向FDA看齐。药品研发是全方面的和国际接轨,包括我们加入ICH ,接受海外的临床试验数据。药品生产和流程可能会具有自己的一些特色,但是研发是需要接轨的。
研发的核心是临床试验,早期临床试验只要进入临床试验就可以拿到临床批件,这种时代一去不复返,现在临床门槛是非常高的,对国外的试验数据的认可,让更多的国外企业在中国同步临床试验。

国际化的政策包括我们的医药的新政,对我们国家各种类型的企业有什么样的利好,对进口企业来说,不好的就是原研药可能会面临一个专利悬崖。但是利好的新消息是可以同步进入中国市场,有个比较长的专利垄断期,能够获得一个很好的收益。
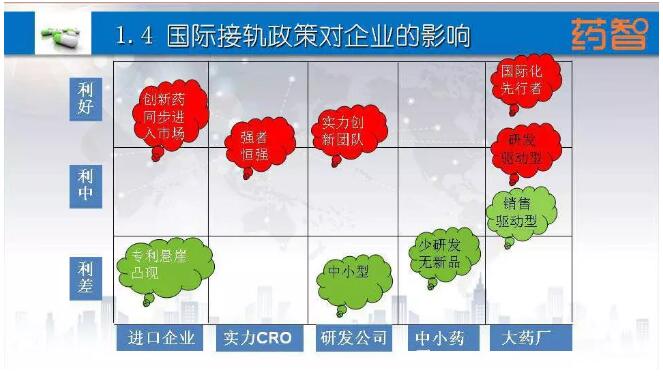
对于CRO是利好的消息,临床走的是专业化道理,更多的产品是真真实实的花巨额资金去做临床。但对于一心做研发企业可能是两极分化。一些小的企业可能就不具备竞争能力被淘汰。对于中小药厂,没有创新能力与国际无法接轨,未来的日子会比较难过。药品新政也促使我们国家的医药企业,从以前的销售驱动型转向研发驱动型。
下图统计的是我们国家近十年在FDA获得仿制药批文的数量,近几年获得批文增长海华是比较快的,未来三到五年每年获批数量会突破三位数。

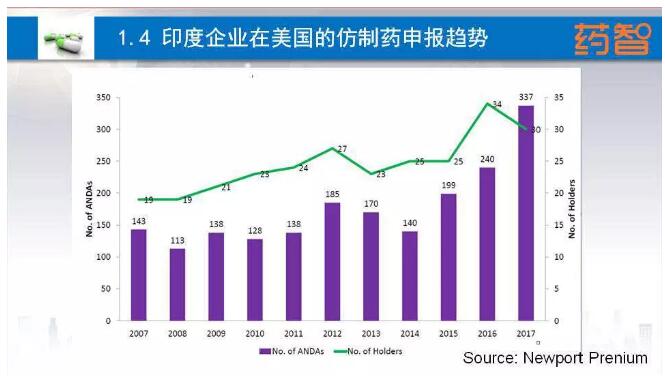
没有对比就没有伤害,印度企业在美国仿制药申报每年都有三百多个批文申报,这才是真正的数量级的差异 。但这并不能说中国企业没有实力,关键是政策引导,政策跟国家接轨,我相信未来十年我们完全是可以超过印度的。

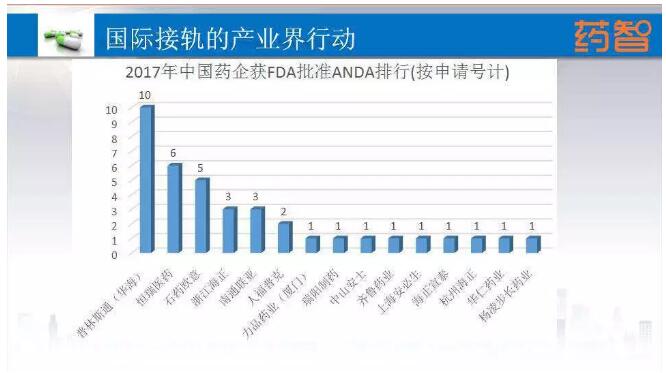
以上是我们国家在美国FDA获得仿制药批文企业的详细情况。我们可以看到像华海、石药、恒瑞这些研发型企业都在走向国际化道路。

上图是药智网做的美国FDA数据库的加强版。

总体来说经过这几年的医药新政,研发的门槛大大提高了。并不是说,随便租个实验室招几个人这个时代已经是过去式了,而是现在做一个仿制药,花费至少几百万甚至上千万。国家的医药新政持续跟国际接轨,我们的医药产业势必会快速发展,跟国际上的医药同行们并驾齐驱。
医药新政后的投资、研发趋势分析
医药新政后具体的研发态势,用数据来进行分析。从这张图可以看到从2015年“722”之后,药品注册持续下滑,2016年药品新政改革之后又进一步的下滑。

那我们现在通过下图来看一下2017年,到底批准了多少不同类别的药物。建议批准的数量达到了480个,但是这个还不是关键中的关键,批准率基本上有接近百分之九十的批准。实际上这也说明我们国家的所谓临床实现默认。临床试验申请报,六十个工作日内没有通过,那么就默认为允许通过。即使是之前递上来的临床申请,一般都会发临床批件。临床批件到手之后值得不值得去做,就需要自己去掂量。
购买批文的时候,我们需要做好评估,但生产批文问题不大,我觉得这应该是最后的盛宴,就这两年批了很多。大家如果有机会能买到临床批文新批的这部分,我觉得还是需要赶快下手。但是对临床批文就要慎之又慎了,很多临床批文有可能做出第一,也有可能做不出来,第二可能即使做出来也没有市场。
仿制药批准率只有百分之7.7,不批准率38% 。

医药新政对行业影响很大,但是基本上没有影响创新药的申报。创新药的申报2017年达到了170个品种,数量惊人,都是1:1类新药,这170个品种到底有多少是能转化为生产批件,结果并不是很乐观。

注册分类改革后的化学药研发申报趋势

政策变化之后总有一批先知先觉的,立马开始调整方向适应新的政策。从上图可以看出,前几个月新政策刚出台需要调整,然后就按照新分类申报。到了2018年之后又明显幅度的增加,按照我的预测2019年还会继续的上扬,国家的研发热情还是非常高的。
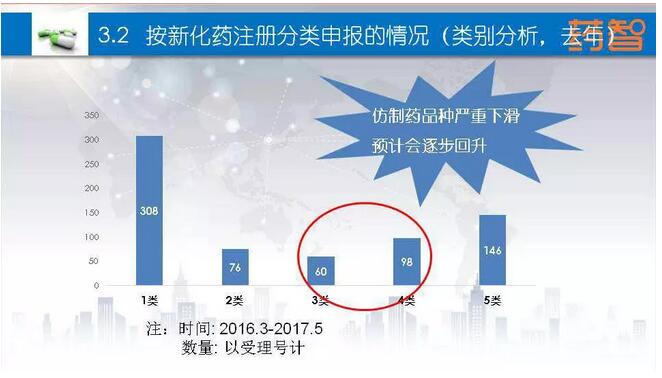
2017年之前仿制药申报数量是非常低的,这就是暂时的低谷。截止到今年2月份,仿制药的申报数量有所回升。
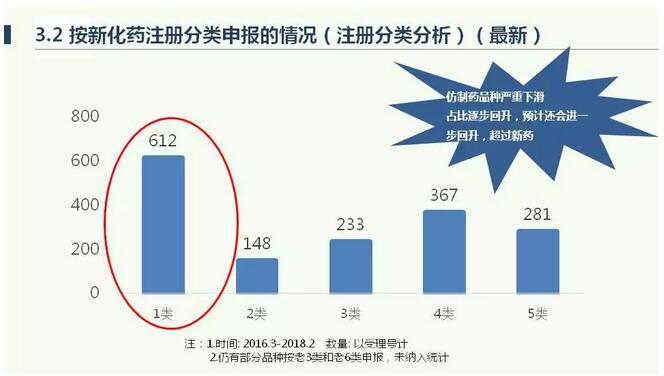
下图表格中的蓝色是国内企业申报,红色是进口,伴随着现在政策的开放,进口的品种还会在增加。

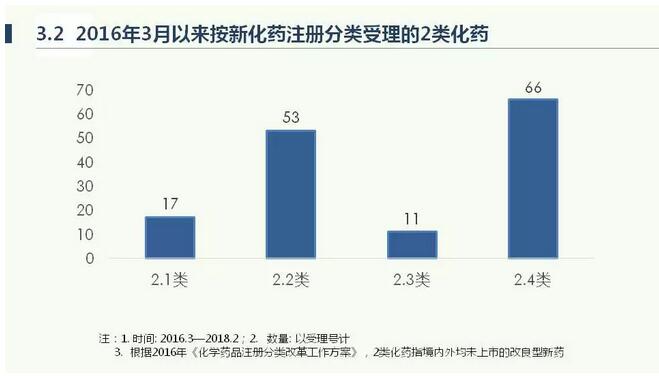

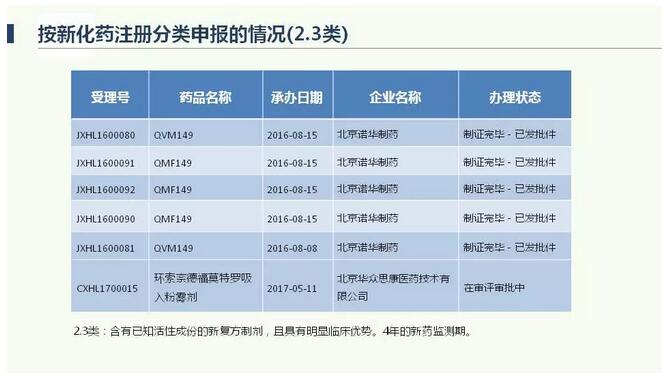
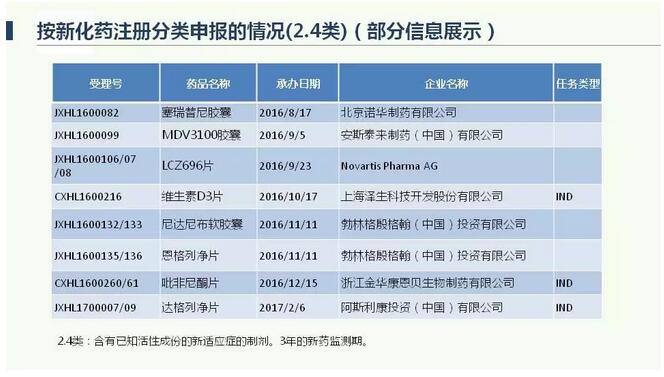

以上是分别四类的统计数据,这并不是最新的,最新的还有增加。
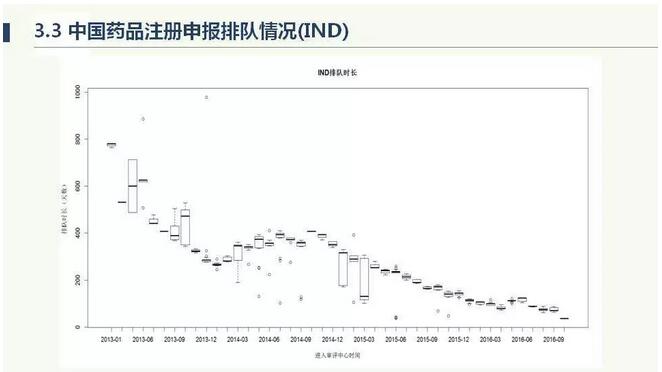
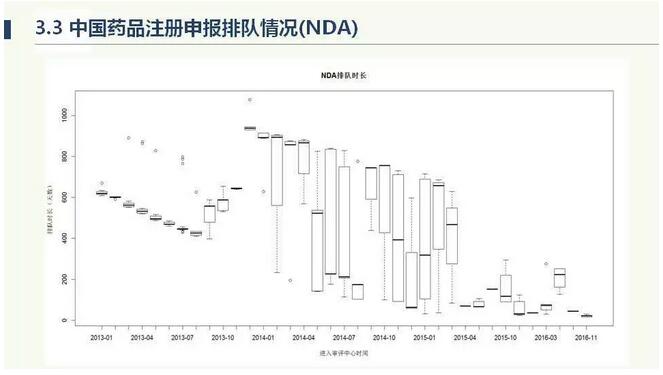
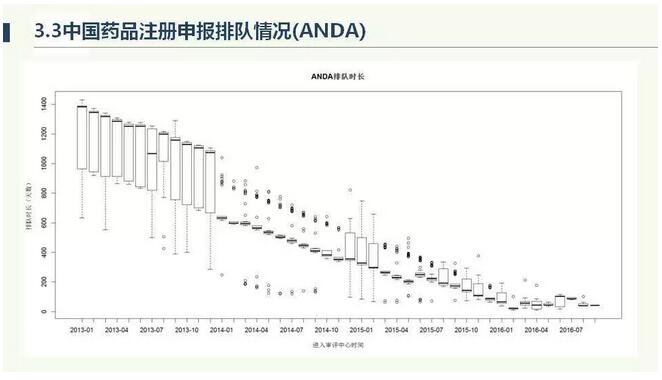

以上四张图,是我和我的同事写的论文,发表在中国食品药品监管杂志里面,通过数据统计药品审评的排队情况。
我们现在正在编一本书,《中国医药研发四十年大数据》预计年底出版,今天我讲的所有数据都来自于药智网的数据。
欢迎关注药融圈官网
看这里:www.pharnex.com
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



