同路医药创始人俞仑:从研发公司总经理角度感受现场核查

声明:此文为药融圈原创,未经允许,不得转载
药融圈第165期专享会嘉宾:俞仑 制剂研发企业济南同路医药创始人
个人介绍

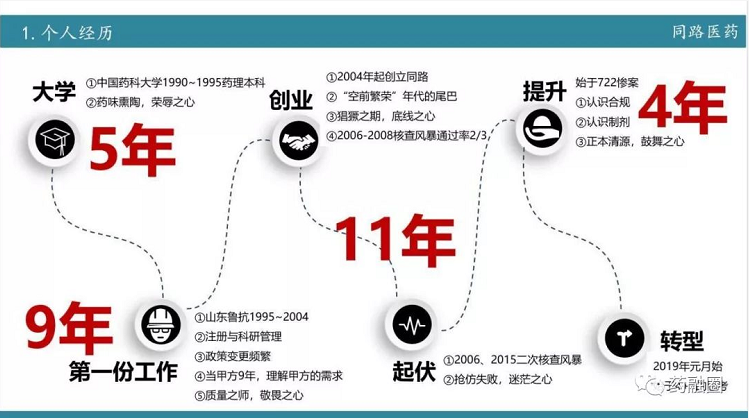

济南同路主要是做制剂研发的一个公司,制剂研发设备以进口高端设备为主,国产设备绝大多数为上海产,进口的制剂配套设备占了绝大多数。
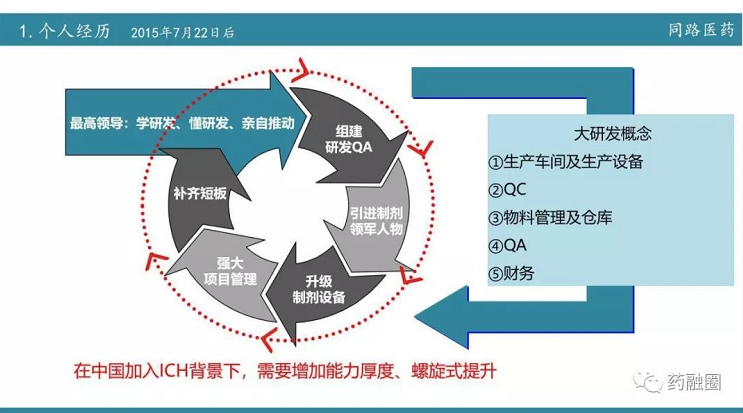
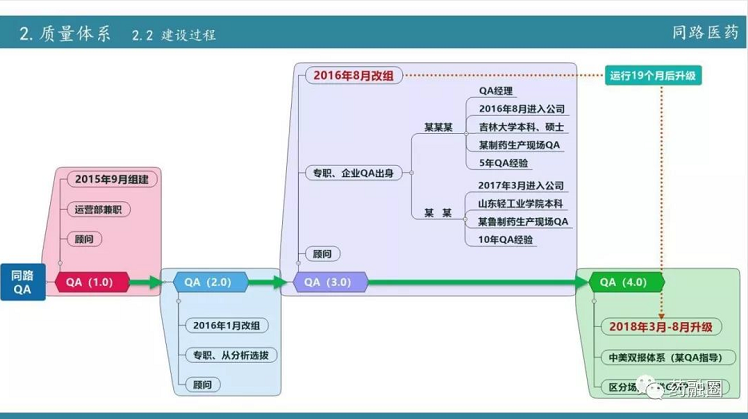
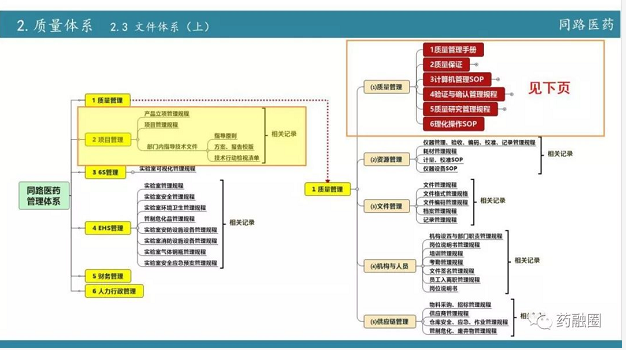
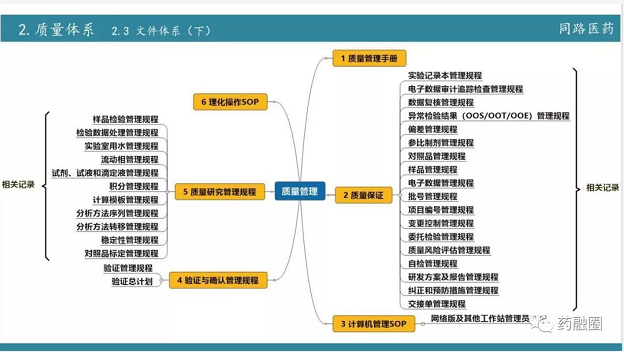
今天虽然讲的是现场核查,但从722后要求合规,要求通过BE,那么研发部门的建设是综合体的建设。首先就是从722之后行业要求提高后新的规范,要做好这件事,同路做的第一步要组建研发QA,也就是质量体系建设。质量体系建设是一个长期的过程,不可能一蹴而就。第二步16年引进制剂的领军人物,同时升级设备;2017年主要以国产高端制剂为主,2018年,主要是以进口制剂设备为主,同时在整个过程中又加强了项目管理。项目管理不单单是指自己公司内部的一个项目管理,更多的是和药品生产企业之间的一个沟通,我们把在实际运营中的经验教训建立一个个文件。
在2018年现场核查中,我们发现一个很重要的问题,核查的研发全过程研发公司的事务只占一少部分,实际核查中在生产这方面核查组花费的精力更大。而生产企业对研发的重视程度明显没达到核查的要求,那么现在的当务之急是提高整个制剂厂家,包括它的生产车间、QC、物料管理、QA和财务等各方面。
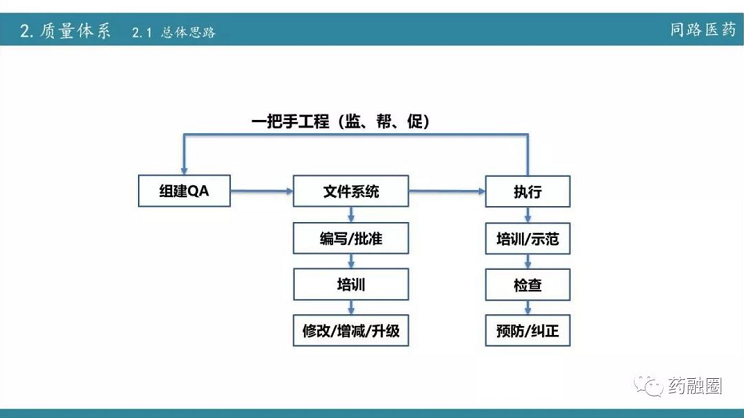
QA的建设
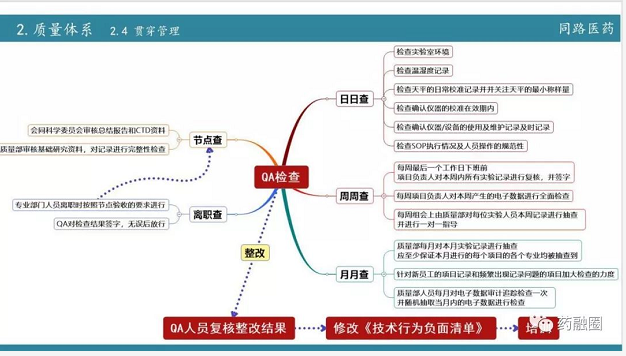
日常的管理
QA要要天天查、周周查、月月查,还有一个节点查,最后员工如果离职的时候还要离职查,并且不是检查完就行,最重要是整改,整改完QA要对复核整改结果,继而亡羊补牢,修改技术行为负面清单。最后对负面清单进行培训,哪些行为是坚决不能发生的,哪些事情是偶尔可以允许出错的!要界定清楚。
打个比方,天平的称量条,打印后要马上黏贴,为预防丢失不允许夹带,因为丢失以后你说不清楚。而有些失误是不能罚的,为什么?比方说我们分析人员,犯了错,如果怕被处罚而隐藏,QA需要花很大的精力才能发现,所以公司的质量文化是要做到让人员主动去报告,他告诉QA我这边出了问题,这个失误应该怎么归属,就是说他主动报告,这样QA的管理成本相对来说要降低了很多,所以一个公司的质量文化不是在于罚!员工被罚怕了,他就不敢去报告了,他会去隐藏。
哪些要罚,为什么要罚?哪些有次数限制,都要让技术人员清清楚楚,还要鼓励员工主动报告。
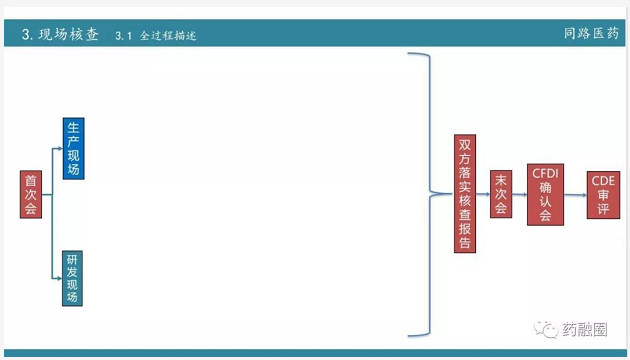
有了这个前面的论述,我们开始说说现场核查是怎么核查的。很多企业没有经历过现场核查,而大家都知道现在比较严,恐惧心理是比较严重的。
第一部分是首次会,第二部分是生产现场核查和研发现场核查,第三部分双方落实核查报告,也就是说你有什么申诉,抓紧时间提出来,而且在十分钟或半小时之内马上拿出证据。第四部分也就是最后一个在企业内做的事情就是末次会,末次会实际上就是宣布缺陷,这个阶段不允许再想翻案。第五部分是在CFDI的确定会,对核查报告做定性结论,最后转到CDE进行审评。
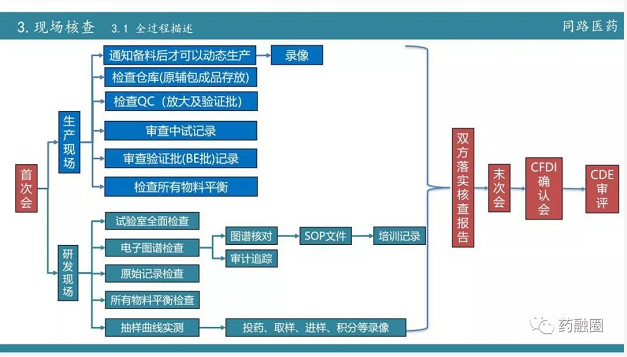
生产现场:通知备料后才可以启动动态生产,检查仓库的时候,原辅料都会检查,检查QC主要针对中试放大和验证。重视BE的批记录,检查所有的物料平衡。
研发现场:相对来说检查很详细,比生产现场要严。对实验室全面检查,所有的文件柜都检查。电子图谱和审计追踪,必查。下面就是查原始记录,包括物料平衡,最后一条是对验证批留样的产品抽样做了四条溶出曲线的实测。
细节:录像,所有的这个核查基本上都要进行录像,因为核查员的分工不同,他们分开去检查,所以用的录像设备的比较多,如果录像机准备不足,那就可以用手机。要提前准备三脚架,因为长时间双手举录像机很累。
色谱全部保存到服务器中,很方便核查官检查,除了检查正常图谱之外,核查官还要找相似的图谱,目的就是找你是否试针,检查你是否挑图谱使用!

首次会非常重要,我们是按照官方要求来准备的,可是实际情况不同,核查组的人员主要是想听听你的整个的研发总结,
第一条,公司的最高领导要亲自参加,首次会的时候要在场。这是对核查组的尊重。另外这是最高领导免费学习的一次机会,看看官方是怎么查的,也评估一下自已公司的水平。
第二条,公司简介不重要!也可以不讲。
第三条,说明你的处方哪里变了,工艺是怎么变的,这个大部分是来自于申报资料。
第四条,说明研发与生产的差异性分析,包括设备原理,生产规模参数等有哪些变化,那么也是要进行汇报的,这部分也是来自于申报资料。
第五条非常非常重要,与原料药供应商有关系,原料是否经过再处理?一定要明确说明,比方说如果精制了,有没有变更申请?如果是原料供应商进行了精制或者改变了工艺,有没有变更申请,这个是非常重要,这是一个坑。没有进行变更工艺,那么可能就非常危险的。在核查时,询问了我们。
第六条稳定性的趋势图,杂质谱等,也是来自于申报资料。
第七条偏差列表,首次会上问,并且在核查时是必查。这部分需要你在平时要用电子表格进行统计。如果你平时不建这个电子表格,QA现场整理这个电子表格的话,就没法陪着核查组进行查了,你分身无术。从管理的角度来说,管理只做一次,这是最节省成本的,也就是说这个工作放在平时去做,不要等到现场核查,或等到接到通知的时候你再做,因为接到通知后一周内你特别忙,这种加班无丝毫意义,所以说这个工作要在放在平时,这点非常非常重要。

第八条方法学转移,工艺转移,当然这个整个过程也是来自你的申报资料。
第九条全部实验的批次,包括所有的失败批次,小试、中试,商业批,不要隐瞒!有时候大家不是故意隐瞒,举个例子,在动态核查前,怕动态做不好,在核查组来前做1-2批,如果结果满意,那么你要记录在案,目的就是为了再演练一下,这个都没问题的。可怕的是你没做好,第一批没做好,你又做了第二批,核查老师就会问你工艺验证早已结束,现在为什么又会生产又会出问题?实际上很难解释过去,但是也不是致命,只是核查时比较难看。
另外第九条与前面讲的偏差一样,平时用电子表格统计好!核查结束后核查组也要带走。实际上工作当天结束你就要统计好。
第十条,来自于申报资料。
第十二条,对外委托实验的汇总说明,这个平时也要用电子表格进行统计好。
第十三条,生产共线,包括细节风险分析,这是来自申报资料的。
第十四条,做电子表格统计,做好交接单,并且做好详细登记,也要带走电子表格。

首次会的时候,核查组向你要的材料,也就是说在现场核查他非常重视的东西。
核查细节,也就是说这个核查员最讨厌这个信口开河狡辩的人,另外核查员原则上只看记录所见的,他不需要你解释,记录上有她就认可你记录上的。
第二个对外所有的委托合同最好尽早签署,否则判定你公司随意性大,所以也是在平时做的。
第三条、第四条、第五条直接见PPT图片。
第六条电子图谱必查且是重点。
第七条前面说过。
我补充一下,一致性评价是有因核查,有因核查可能是被举报,也有可能是因为CDE审评人员看不懂你的申报资料,所以要去现场核查一下。
就是说核查不一定每个品种都被核查,那么核查到肯定是有原因,但原因你可能不知道。
一致性评价核查不是所有都查,是药审中心提出,可能查研发现场,可能会查生产现场,可能会查医院,也可能只查生物检测单位。这是一次性评价,新产品申报核查肯定是都要去核查的。所以一致性评价有的人查有人不查,也可能只查你的BE,也可能是不查。

第八条延伸核查,一般查你对外委托实验,产生了怀疑,另外一种延伸核查,可能是因为你的原料药合成步骤过短。
第九条是非常非常重要,一定要有这个表格的,就是你的BE批、注册批的工艺参数,还有工艺规程中规定的参数,验证批的工艺参数和动态批的工艺参数一定是一致的!
第十条参比制剂是按片来核查的,包括采购量,使用量,存量,实验过程剩余样品不要销毁。
比如说我们做长期的时候,有时候取一板二版,可能用不完剩那么两三片,不要销毁,放在自封袋里,扔到物料箱里即可,总之要找得到就可,不要销毁!
第十三条,偏差必查,有没有?有多少?都很关键,不仅是在PPT列表,而且我前面也说了,一定要有电子表格,核查完要要带走的!
第十四条,物料取样是不是符合SOP,举例说我们工艺验证过程中,规定取样的份数,与检验的份数是否一致。动态核查时,是否按工艺规程取样。生产企业在这方面不出问题的不多。为什么不按SOP取样呢?更深层的原因是工人对研发中的验证不重视,没将研发中的验证按GMP要求去做。

第十五条非常重要,据我了解,大部分企业在核查时,不允许非车间人员参与动态生产,而且还不允许非QC人员参与检验。也就是说研发人员不允许进入生产现场。这时会出现几个问题。第一个,车间工人不能独立完成动态批,第二个,生产企业QC人员,不会做溶出曲线。原因出在验证批时,基本上都研发人员代劳了。这点一定要改正,在转移方法学时,一定让QC人员学会怎么做溶出曲线。
第十六条,重点观察的是车间人员对生产工艺规程的执行的情况,你是不是按照SOP去执行。
第十九条,有可能对动态批,或者BE批,或者验证批取样,现场进行溶出曲线比对,或者说封样后,送到指定药检所进行复核!
第二十一条,签名、考勤或五险必查一项或多项。不一定查哪个,我们公司查的是签名,对同一个人,多次要求核对签名。

由第二十二条说明,与以前核查不同,以前首先看文件,现在不先看文件,根据你错误的试验行为和动作,再看你的原始记录,再看SOP,或查你的培训记录,也就是说根据问题,按图索骥把你的整个体系里边所有的关键点全部查到。这种核查和以前就不一样了,以前就是来了以后我看你的文件,看组织构架图等等,现在根本不看,核查组根据问题去找你的文件,根据文件找你的培训记录,
第二十三条,必查。
第二十四条,体系中部分文件前期没有,试验中也无法可依,在经过一段时间后,又增加了该项文件,核查组不认为是缺陷。但是在接到核查通知那天起再增加的文件不认可。
第二十六条,很重要,验证批的长期实验,申报资料中报谁的数据?如果是新产品申报,一定是报药品生产企业的。一致性评价呢?注射剂必须报药品生产企业QC的检验数据!口服可以报研发公司的数据。
但是,研发公司还是要进行长期试验,原因在于要与生产企业的长期数据对比一下,两家都做。以防药企QC检验长期样品出问题后,不知道是样品原因还是检测原因。
第二十七、二十八条,天平称量数据要打印,网络版工作站+服务器还是很重要。能增加核查级对我们的信任度。
另外大家站在核查组的角度来说,如果是单机版,每台电脑都要查,工作量非常巨大,否则他会怀疑你隐匿图谱。

我说说经验吧,首先最高领导要全程参与的,包括生产企业最高领导也要参与,那么才能提高把研发纳入GMP体系的一个认知,同时检验研发体系的水平!
此条非常重要的,因为绝大部分企业没有将研发纳入GMP管理,很多企业有个观点——没拿生产批件QA就不管,QC也不管的,生产车间也只是配合研发放大和验证。
第二条,当然组建研发QA越早越好,专业、负责任,另外企业应该赋予研发QA绝对的权力,必须对QA信任,因为我们研发人员对合规没有概念,不像生产车间的人员,GMP基本上已深入人心。
下面说QA天天查,这个是必然,特别是早期。

第八条尽早开展自查,越早越好,不要等到CFDI下达核查通知书,再去查缺补漏,把工作做在平时,第二个就管理只做一次,以降低管理成本。
我的经验是管理工作或者说我们平时做的工作,既要针对申报资料,也要针对现场核查需要。
提前做好第九条,提前做好电子表格自查,前面我讲了,因为到核查时是必需的。
第十条,一定要给员工千叮咛万嘱咐,不要信口开河,不要狡辩!
第十一条非常重要,核查员是分开检查,各部门的骨干或者负责人也要分别跟随,这个时候骨干分散,如果不提前做好,临时统计表格的任务必定是负责人骨干,那么谁去陪核查员?否则核查员碰到的都是就不太懂的员工到或者新来的员工,或者说没有参与这个项目的员工,那你只等着倒霉了。
第十二条,人是感情动物,获得核查员的好感非常重要,网络版工作站和天平打印是最基础的保障,偏差调查充分,人员应对有序,资料反馈及时,能保障你取得好感,还有就是你做了就做了,没做承认错误,别似是而非,获得好感和信任是非常重要的!
第十三条,生产企业在物料上实事求是,不虚构批次,物料管理软件往往最能说明问题。

关于教训
最大的教训,就是做商业批验证不能由研发人员代劳,商业批验证一定是由车间人员独立完成,研发人员的工作是转移方法和交接工艺,包括培训。
第二条,进入生产车间,就必须按GMP的套路来做,QA必须参与管理。
第四条,研发人员一定重度参与验证方案制订,一定不能省事。
另外给生产企业提个建议,研发奖励一定要包括生产车间、QA、QC等部门,不把他们纳入到奖励中来,他们又怎么会把研发纳入GMP体系中呢?
第六条原始记录、交接单漏写,事后不要补。在接到核查通知之日起到来核查,一般有七天时间,这个七天大家加班加点来改正错误,其实是一种错误行为。正确的做法,是QA自查出来,并且做出了说明,只要不是特别非常重大错误,核查组都不定义为缺陷,自查一定要早尽作出说明,评估风险。千万千万不要补,任何事情不要补!

长期稳定性预测,非常非常重要的,我们不能只关注BE是否通过。特别是包材,这是我们最易忽略的地方。
最后我说一句,我们经历的是2018年下半年的核查,据核查官说是最严的一个时期。
因为ICH这个背景,所以说我觉得ICH背景对中国制药的影响是非常大的。中国早晚会是一个国际化开放性的一个格局,无论你对自己要求高低,都要拿ICH来做标准。
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置: