想要新药更快上市?这些试验设计方法更受监管机构青睐!
近日,来自中国清华大学药学院、清华-北京生命科学研究中心、国家药监局创新药物临床研究与评价重点实验室、北京大学人民医院药学部和美国杜克大学医学院的研究者在杂志Drug Discovery Today联合发布题为“Evaluation of clinical trial designs for novel anticancer drugs in China: A cohort study of drugs approved between 2015 and 2021”(评估中国新型抗肿瘤药物的临床试验设计:对2015年至2021年批准药物的队列研究)的研究文章。
该文分析了在中国批准上市的抗肿瘤药物,在临床试验过程中所采用的不同试验设计方法。通过分析,研究发现在中国新型抗肿瘤药物的临床试验中,逐步采用更加先进的试验设计方法,以加速药物批准上市。
本文研究对于了解中国的抗肿瘤药物研究现状、推进抗肿瘤药物研发、提高患者治疗水平有着重要意义。
-
鼓励采用灵活的临床试验设计来开发新型抗肿瘤药物。
-
分组序贯试验设计(Group sequential design)是新型抗肿瘤药物临床试验中应用最广泛的设计方法。
-
单臂试验设计和适应性试验设计可缩短新型抗肿瘤药物的临床试验时间。
-
中国需要加强对抗肿瘤药物灵活试验设计的监管。
数据来源和统计分析:
中国国家药品监督管理局 (NMPA) 自 2015 年至 2021 年批准的所有新药 (NMEs),以及抗肿瘤药物的适应症。
通过查阅每种药物的审评报告或最新药品说明书,确定各适应症支持获批的关键试验。两名调查员抽取试验设计、癌症类型、癌症适应症、药物研发的来源(国产药物或进口药物)、加速评审计划、主要疗效终点、每个关键试验所包含的患者数量、IND 批准日期、NDA/生物制品许可证申请日期和 NDA/BLA 批准日期等细节。
癌症的主要疗效终点包括响应率 (RR)、无进展生存期 (PFS)、总生存期 (OS) 等。
研究者将临床试验设计分为单臂试验设计(single-arm design trial)、传统随机对照试验设计(traditional randomized controlled trial)和适应性随机对照试验设计(adaptive randomized controlled trial)。
-
单臂试验设计:只有一个治疗组,没有同时进行的对照组(安慰剂、活性或无治疗),用于评估人群中新治疗或干预的有效性和安全性。
-
传统随机对照试验设计:所有关键试验参数在临床试验计划中预先定义,并在试验执行过程中保持不变。
-
适应性随机对照试验设计:允许事前计划基于已积累的数据(期中数据),对正在进行中的试验的各方面进行修改,同时保持该试验的有效性和完整性。
研究者共确定79种新药和140个抗肿瘤药物适应症,包括31种国产(58个适应症)和48种进口抗肿瘤药物(82个适应症)。相比血液肿瘤,这些药物更多用于实体瘤的治疗(34/140 VS 106/140,p < 0.001)。各适应症按癌症种类排序如下:
-
肺癌(23%) -
淋巴瘤(13%) -
乳腺癌(11%) -
肝癌(6%) -
前列腺癌(6%) -
白血病(5%) -
多发性骨髓瘤(5%)
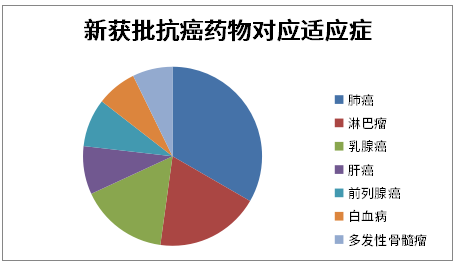
在这些癌症适应症中,有94个(67%)获得了常规批准,而46个(33%)获得了条件批准。此外,80%的抗肿瘤药物适应症获得了优先审评。
支持抗肿瘤药物批准的主要有效性终点包括:缓解率(response rate,RR)(33%)、无进展生存期(progression-free survival,PFS)(32%)、总生存(Overall survival,OS)(14%)、PFS与OS的组合(13%)和其他(8%)。
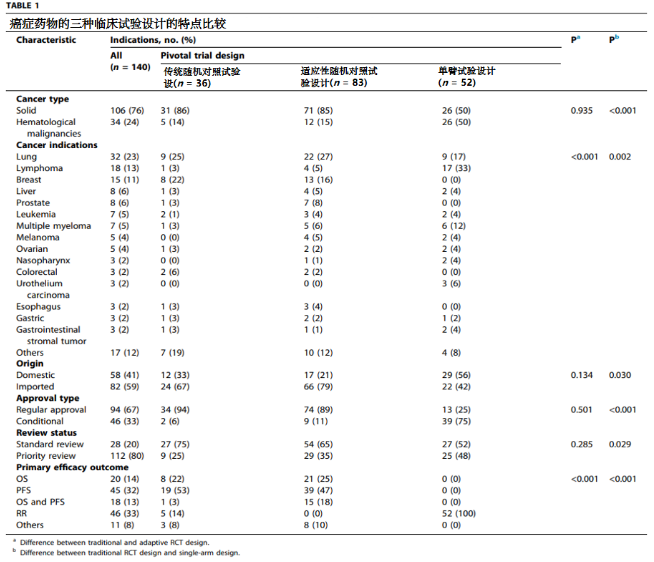
共有171个临床试验被确定为重要的关键临床试验,支持140个适应症的上市批准。关键临床试验中,各类型试验设计按数量排序如下:
-
适应性随机临床试验设计(83个,占比49%) -
单臂试验设计(52个,占比30%) -
传统随机对照试验设计(36个,占比21%)。

图1 2015年至2021年期间中国获批抗肿瘤药物临床试验设计的变化
图1显示了从2015年到2021年,这三种临床试验设计所批准的抗肿瘤药物的变化情况。
如图,单臂临床试验和适应性随机临床试验的应用增加,而传统的随机对照试验设计则没有固定趋势。
在83个适应性随机临床试验设计中,大部分为成组序贯试验设计(81/83,98%),仅有一例为无缝Ⅱ/Ⅲ期试验设计以及一例为无缝Ⅱ/Ⅲ期试验设计与成组序贯试验设计相结合的设计。
适应性随机临床试验设计在肺癌(22/83,27%)、乳腺癌(13/83,16%)和前列腺癌(7/83,8%)中使用最频繁。
82个成组序贯试验设计中,大多数进行了一次(范围:1-3次)中期分析,控制Ⅰ型错误主要采用Lan DeMets和O'Brien Fleming方法。
先说结论,作者认为:
1.适应性随机对照试验和传统随机对照试验在癌症适应症和主要有效终点等方面存在显著差异。
与传统随机对照试验相比,适应性随机对照试验显著缩短了临床试验的持续时间和药物研发时间,但需要更多的受试者参与。二者在新药来源、批准类型和审查状态方面没有显著差异。
2.单臂试验设计特点与传统随机对照试验设计有很大差异,主要体现在癌症类型、适应症、新药来源、批准类型和审查状态。
相比于传统的随机对照试验,单臂试验所需的临床试验时间和总药物开发时间显著减少(见下图)。
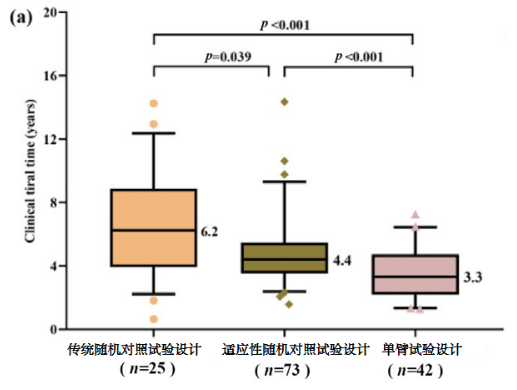
图2a 临床试验时间中位数

图2b 新药申请/生物类似物申请时间
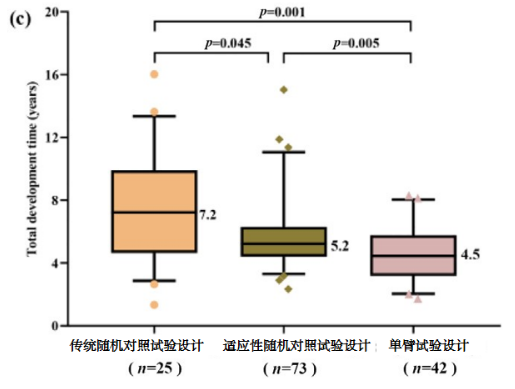
图2c 总药物开发时间中位数
(临床试验时间中位数:3.3与6.2年,p < 0.001,图2a;总药物开发时间中位数:4.5与7.2年,p = 0.001,图2c)在新药申请/生物类似物申请时间方面,这些试验设计差异不显著(图2b)。
此外,在受试者数量方面,支持抗肿瘤药物获批的单臂试验的受试者招募更少(中位数为97,差异显著),而传统试验(中位数为291)和适应性随机试验(中位数为498)的受试者招募更多。
自2015年中国推行药品监管改革以来,单臂试验和适应性随机对照试验的比例显著高于传统的随机对照试验设计,且呈上升趋势。这表明中国药品监管机构接受更灵活的临床试验设计,如单臂试验和适应性随机对照试验设计,以适应现状(中国癌症患病率和发病率方面位列世界第一)。在中国,目前许多癌症患者仍缺乏有效的治疗方法,更灵活的临床试验设计能够缩短试验周期,提高试验效率,缓解这一问题。
单臂临床试验设计大大缩短了临床试验的时间(中位数:3.3年),部分归因于单臂试验所需患者数量较少。然而,单臂试验临床有效性仍受到广泛挑战。
建议中国加强对单臂试验的监管,包括需要后期的确证性临床试验以提供支持OS获益或健康相关的生活质量的数据。
近年来,可预先计划调整的适应性随机对照试验设计因其适应性、统计效率和伦理合规性受到广泛关注。本研究发现,相比传统的随机对照试验设计,适应性随机对照试验设计:
-
显著缩短临床试验时间(6.2个月对比4.4个月)
-
对受试者数量有更高要求
本研究中,适应性随机对照试验设计主要是成组序贯试验设计,也有少数无缝Ⅱ/Ⅲ期设计,而其他适应性随机对照试验设计相对少见。这与FDA和EMA的经验总结一致。
主要原因在于成组序贯试验设计和Ⅱ/Ⅲ期无缝设计为I类错误提供了足够的控制,保持试验完整性,并获得监管机构认可。
鉴于适应性设计在临床试验中使用愈发普遍,国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use ,ICH)于2019年启动E20计划,将进一步推动其在多地区临床试验(MRCT)实施。然而,适应性设计仍面临一些挑战,包括I类错误、潜在操作偏差、统计学复杂性以及监管机构间的要求差异等。
单臂试验设计未进一步分类成适应性和非适应性设计,主要是由于单臂试验引入适应性变化可能会进一步降低疗效证据可靠性。
此外,研究者主要通过NMPA审评报告、发表的文献、临床试验方案和clinicalTrials.gov确定适应性随机对照试验设计是否得到评估。如果上述数据中未描述适应性随机对照试验设计的特性,可能导致适应性随机对照试验设计的数量统计遗漏。
总体而言,在面对严重危及生命的癌症尚缺乏有效治疗的情况下,采用新颖的试验设计,包括单臂试验设计和适应性设计,有助于加速新的肿瘤药物的上市,满足临床需求。然而,基于单臂试验设计和适应性设计的抗肿瘤药物获批,在中国和其他国家仍面临挑战。
致谢
-
本研究获得了清华-北京生命科学中心的支持。
-
感谢Zhuangqi Li和Jingwen Liu对数据收集的贡献。 -
本文中的观点为作者的个人观点,可能不反映国家药品监督管理局的立场。
Reference
1. Chow SC. Adaptive clinical trial design. Annual review of medicine 2014; 65: 405-15.
原文:
https://doi.org/10.1016/j.drudis.2023.103578
<END>
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



