补体龙头Apellis以多肽PK抗体,超罕见病迎来新治疗格局
补体系统,也称为补体级联反应,是先天免疫系统和适应性免疫系统的重要组成部分,可辅助或补充抗体与吞噬细胞清除病原体和受损细胞、介导免疫溶菌或溶血等作用,固称为补体(Complement)。该系统主要由肝脏合成的多种蛋白质组成,并在血液和组织中循环,涉及大约30多种蛋白质和蛋白质片段,约占血清中球蛋白的10%。当补体系统被激活时,其中的蛋白酶便会切割特定的补体蛋白质以释放细胞因子并引发进一步的级联反应。该过程可由三条生化途径激活:经典途径、凝集素(MLB)途径和替代途径。当补体系统异常激活时,可导致细胞和组织损伤,引起自身免疫性疾病和炎症性疾病。
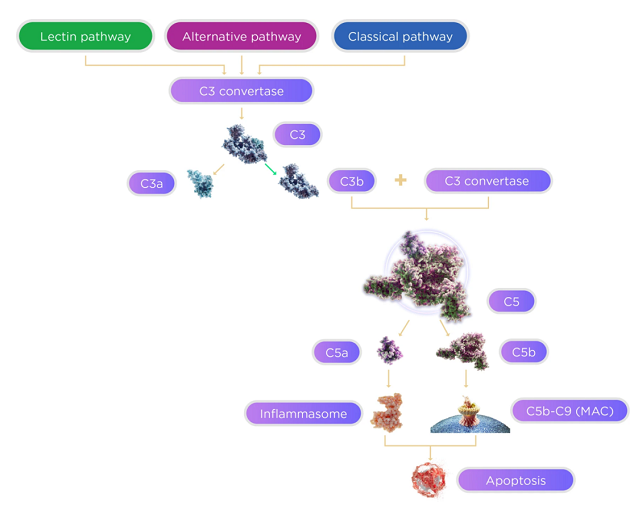
补体级联反应示意图源:Eye
(DOI:https://doi.org/10.1038/s41433-021-01765-x)
新型多肽Pegcetacoplan拟打败罕见病重磅药物
在补体药物领域,罕见病巨头Alexion公司曾打造了一款重磅炸弹Soliris®(eculizumab), 这是一款first-in-class补体C5单克隆抗体,也是全球首款阵发性睡眠性血红蛋白尿症( PNH )特异性治疗药物。PNH是由补体介导的一种罕见血液疾病,会引起慢性血管内溶血,可危及生命,若不加以治疗,患者五年内死亡率高达35%。2018年,Soliris®(eculizumab)的长效版Ultomiris ( ravulizumab )获批。这两款药物是Alexion的主打产品, 2020年销售总额超过50亿美元。鉴于当时Alexion在补体介导罕见病领域的领导地位,2020年底,跨国巨头阿斯利康宣布以390亿美元收购Alexion,创下当年医药领域最大手笔并购案。
资料显示,全球范围内阵发性睡眠性血红蛋白尿症(PNH)患者人群仅有约1.5万人,属于极罕见疾病。在此之前,该病只能通过补充铁剂、糖皮质激素、输血、骨髓移植等手段进行非特异性治疗。直到2007年Soliris®(eculizumab)获FDA批准上市,PNH患者才迎来首款也是当时唯一一款治疗药物,但该药物售价高昂,据统计,大多数患者年度治疗费用高达67.83万美元,且需要终身治疗,使得该药在这一超罕见适应症人群中取得了极高的销售额。除了PNH,Soliris®(eculizumab)后来还获批了新适应症,包括非典型溶血性尿毒症综合征(aHUS)、全身型重症肌无力(gMG)以及视神经脊髓炎谱系障碍(NMOSD)。
然而,有研究发现,虽然Eculizumab可有效消除血管内溶血,但大多数使用Eculizumab治疗的PNH患者仍会经历轻度至中度的血管外溶血症状,这是由于该药物靶向补体系统的下游C5蛋白,而处于上游的C3蛋白仍可被裂解,从而引起红细胞表面C3d片段沉积,大量红细胞被脾脏和肝脏拦截并破坏。因此患者血红蛋白水平难以达到正常范围,大部分患者仍然无法完全摆脱输血治疗。这一问题也为众多后来者留下了机会。
不出所料,Eculizumab在2021年遇到了“拦路虎”。2021年5月,美国FDA批准Apellis Pharmaceuticals的C3抑制剂Empaveli(pegcetacoplan)注射剂用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。这是首个获批用于治疗PNH的C3靶向疗法,可用于治疗初治PNH成人患者,以及从接受C5抑制剂Soliris®(eculizumab)和Ultomiris®(ravulizumab)治疗转换为Empaveli(pegcetacoplan)治疗的患者。这意味着补体领域在近15年之后迎来了第一个新的药物类型。

此次批准基于头对头的3期PEGASU试验结果,在该研究中Empaveli(pegcetacoplan)达到了主要终点。在治疗第16周,Empaveli(pegcetacoplan)治疗组血红蛋白水平相对于基线的变化优于Soliris(eculizumab),且在避免输血方面达到了非劣效性,接受Empaveli治疗的患者85%无需输血,而使用Soliris为15%。值得一提的是,Empaveli(pegcetacoplan)是首个在改善血红蛋白水平方面显著优于Soliris(eculizumab)的药物,或将改变当前阵发性睡眠性血红蛋白尿症(PNH)的治疗标准。Empaveli(pegcetacoplan)的本质是一种聚乙二醇化环肽,可特异性结合C3和C3b,可见多肽这种传统的药物类型并不输于时下最主流的抗体类药物。2021年12月,该药在欧盟获批用于PNH成人患者,商品名Aspaveli®。Apellis正在进一步推动该产品成为PNH患者的一线治疗方案。
Apellis Pharmaceuticals创立于2009年,联合创始人兼首席执行官CedricFrancois博士曾是一名外科医生,确切地说是一名“医师科学家”。他曾参与1999年全球首次手部成功移植的手术,以及2005年全球首例脸部移植手术。由于移植工作往往需要处理免疫排斥等棘手的问题,CedricFrancois虽是外科医生,但他在免疫学和免疫系统介导的疾病领域具有专长,且医生背景使他对于临床未满足需求具有深刻的理解。这也是Apellis创立的基础之一,这家制药公司致力于通过对免疫系统的重要组成部分——补体系统进行调控,以治疗那些存在高度未满足需求的疾病。2017年11月,Apellis完成1.5亿美元IPO(NASDAQ:APLS)。

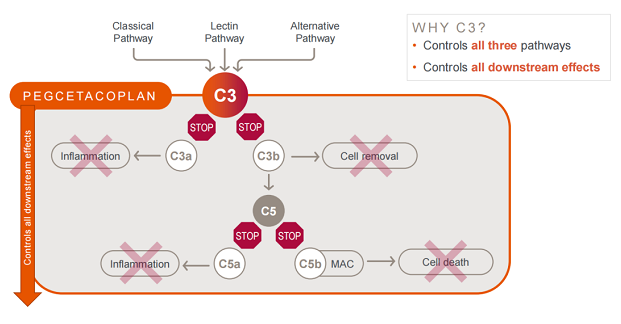
Apellis公司目前的开发工作主要根植于补体系统中的C3蛋白,C3蛋白处于补体级联反应的中枢位置,是血清中含量最高的补体成分,可对补体系统的全部3条途径(经典途径、凝集素途径和替代途径)以及所有的下游效应进行调控。对C3蛋白水平进行抑制或可对补体依赖性自身免疫和炎症性疾病具有广泛的控制作用。
产品管线
作为补体领域新晋的全球领导者,Apellis Pharmaceuticals正围绕C3靶点布局多款治疗产品并积极拓展产品适应症,疾病领域涉及眼科、肾病学、血液学和神经科学等,同时也正在探索结合基因疗法、siRNA等新技术手段治疗疾病的潜力。
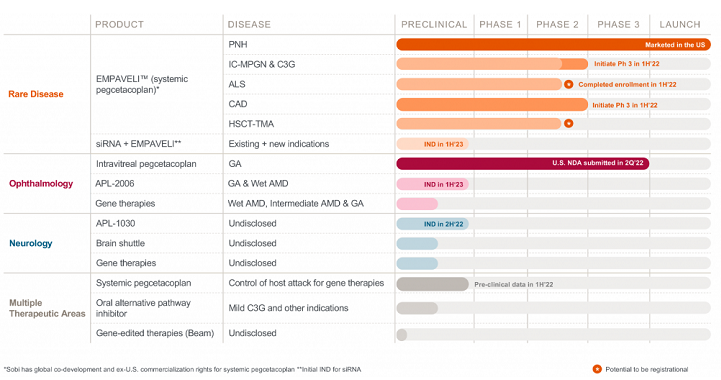
Apellis产品管线信息非最新(更新至2021年6月)
Pegcetacoplan开发计划:
Empaveli/Aspaveli(pegcetacoplan)是Apellis目前唯一获批的产品。2020年10月,Apellis与Swedish Orphan Biovitrum(Sobi)宣布达成合作,将在全球范围内共同开展Pegcetacoplan的开发与商业化工作。根据协议条款,Sobi将与Apellis在全球范围内共同开发Pegcetacoplan,并获得该药在美国以外地区的独家商业化权利。Apellis将保留Pegcetacoplan在美国的商业化权利以及该药针对眼科适应症的全球商业化权利。同时,Sobi将向Apellis支付2.5亿美元的预付款以及8000万美元的临床开发费用,Apellis还有资格获得高达9.15亿美元的监管和商业里程碑付款以及分层两位数版税。
目前,Empaveli(pegcetacoplan)已在美国、沙特阿拉伯、澳大利亚获批并销售,在欧盟和英国以Aspaveli®为商品名进行销售,用于治疗阵发性睡眠性血红蛋白尿症(PNH)。此外,Apellis还构建了一个ApellisAssist系统,可为患者提供针对产品和疾病的教育、自行输液训练、保险支持,以及针对特定患者的经济援助。
2021年6月,Apellis在其研发日公布了一种在开发中的新型给药装置,步骤更简单,自行给药更方便,方便携带且缓解了对针头的恐惧,提升患者治疗体验。

由于Pegcetacoplan既可以通过皮下注射实现全身给药,也可以通过眼部注射实现玻璃体内给药,Apellis正在开展Pegcetacoplan用于眼科领域的临床试验,并与Sobi合作探索该药在血液学、肾病学和神经病学领域的应用。
·眼科
Pegcetacoplan的玻璃体内注射制剂正在被开发用于治疗地图状萎缩(GA),该病是干性年龄相关性黄斑变性(dAMD)的晚期形式,是导致不可逆转性失明的主要因素,在全球范围内影响约500万人,且目前没有专门的治疗药物获批(有关AMD这一视网膜血管性疾病,药融圈早前在Kodiak的文章中有所介绍)。Apellis认为Pegcetacoplan对于GA患者来说是一个突破。因Pegcetacoplan可以阻断C3a和C5a的产生,并通过抑制C3阻止了C3片段在视网膜细胞上的积累,因此该药可以控制视网膜环境中的补体激活,使其恢复到静止状态。该药有望成为首个获批的GA治疗药物,已向FDA提交NDA申请。
针对GA适应症,Apellis在2022年视觉与眼科研究协会年会(ARVO2022)上公布了3期DERBY试验(入组621名患者)和OAKS试验(入组637名患者)的详细18个月治疗数据,结果显示玻璃体内(每月或隔月)注射Pegcetacoplan可持续减少GA患者眼内病变生长,且显示出良好的安全性,患者中心凹外和中心凹病变生长实现持续且具有临床意义的减少。Pegcetacoplan是首个在大规模3期试验中显著减缓GA进展的创新药物。
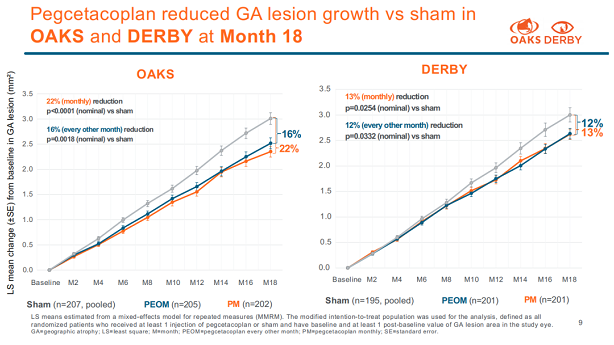
药融圈旗下,药融云数据www.pharnexcloud.com显示,美国FDA已授予Pegcetacoplan治疗GA的快速通道资格。2022年6月1日,Apellis宣布已向美国FDA提交该药用于治疗GA的NDA申请,若进展顺利预计将在2022年Q4获得监管批准,该公司还计划在2022年下半年向欧洲药品管理局(EMA)提交该药的上市许可申请。为了应对未来潜在的批准和商业化工作,Apellis将在美国建立专门的眼科团队,并开始在德国和澳大利亚组建欧洲团队和附属公司。
·罕见病
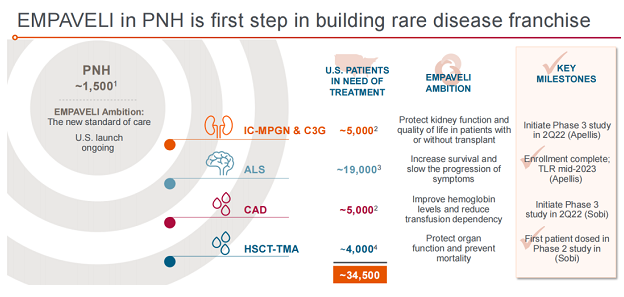
阵发性睡眠性血红蛋白尿症(PNH)只是Pegcetacoplan在罕见病领域深度布局的第一步。针对皮下注射型Pegcetacoplan,其他正在开发的适应症包括C3肾小球病(C3G)、免疫复合物膜增生性肾小球肾炎(IC-MPGN)、冷凝集素病(CAD)、造血干细胞移植相关血栓性微血管病(HSCT-TMA)以及肌萎缩侧索硬化症(ALS)。

药融云,全球研发数据库
IC-MPGN和C3G是极罕见的肾脏疾病,在美国和欧洲分别约有5000例和8000例患者。这两种疾病的根本原因和进展十分相似,包括补体级联的过度激活,肾脏中C3分解产物的过度积累导致炎症和器官损伤,约50%的患者会在确诊后的5到10年内出现肾衰竭,且目前没有疗法获批。2022年6月7日,Apellis和Sobi联合宣布Pegcetacoplan用于治疗IC-MPGN和C3G患者的3期VALIANT试验已完成首例患者给药,该研究旨在评估Pegcetacoplan对大约90名12岁及以上原发性IC-MPGN或C3G患者的疗效和安全性。
在ALS患者中,整个运动系统中C3水平升高可能导致慢性神经炎症和运动神经元死亡。2020年11月Apellis启动了2期MERIDIAN试验,旨在评估Pegcetacoplan在ALS患者中的安全性与有效性。2022年3月,该试验完成患者入组,招募了约250例ALS成人患者,预计将在2023年中获得顶线数据。
CAD是一种严重、慢性、罕见的血液疾病,影响美国和欧洲约10500人,患者可能患有慢性贫血,且血栓形成的风险增加,如中风;HSCT-TMA是一种罕见的血液疾病,可能是骨髓移植的致命并发症。Pegcetacoplan针对CAD和HSCT-TMA适应症的研究目前由Sobi主导。2022年初,Pegcetacoplan用于HSCT-TMA患者的2期试验完成首例患者给药,Sobi预计将于2022年第二季度启动该药用于CAD患者的3期试验。
除此之外,Apellis还与商业和学术研究人员合作,评估利用腺相关病毒(AAV)载体递送Pegcetacoplan用于基因治疗的潜力。
其他候选产品:
除了上述临床开发项目,Apellis还计划在未来两年内将4款新的候选产品推向临床:
包括一种siRNA候选药物,旨在与Empaveli(pegcetacoplan)进行组合,以减少肝脏C3蛋白的产生,或可降低Empaveli治疗频率。公司计划在2023年上半年提交该治疗组合的IND申请。
APL-1030是一种新型的C3抑制剂,通过鞘内给药递送至大脑,具有治疗多种神经退行性疾病的潜力,公司计划在2022年下半年提交APL-1030的IND申请。该候选药物是首个具有脑活性的C3抑制剂。
APL2006是一种双特异性C3和VEGF抑制剂,旨在通过玻璃体内给药治疗地图状萎缩(GA)和湿性AMD(wAMD),计划在2023年上半年提交IND申请。该候选药物有望为wAMD患者带来潜在的Best-in-Class疗法。
以及一款口服补体系统替代途径抑制剂,用于某些肾脏疾病。
同时,Apellis计划继续与Beam Therapeutics合作开展研究活动,在多个治疗领域开发基因编辑疗法。2021年6月,Apellis与Beam宣布了一项为期五年的独家研究合作,旨在利用Beam专有的碱基编辑技术来发现针对补体系统疾病的新疗法。根据合作条款,双方将针对C3和其他补体系统靶点合作开展六个研究项目,重点关注眼科、肝脏和脑部疾病,Beam将有资格从Apellis获得总计7500万美元的里程碑付款。
财务状况
2021年,Apellis全年总收入6660万美元,其中产品收入1510万美元,均来自Empaveli(pegcetacoplan)的商业销售业绩,与Sobi合作相关的里程碑和许可收入共5140万美元。值得一提的是,Empaveli(pegcetacoplan)的用药群体大多数是先前使用C5抑制剂治疗的群体,由Ultomiris(ravulizumab)转换而来的患者占这些使用过C5抑制剂治疗群体的75%,患者依从率超过95%。公司全年研发费用为4.259亿美元,主要是由于与Beam的研究合作增加了7500万美元支出,以及其他项目的研发支出;一般及行政支出为1.768亿美元。公司全年净亏损7.464亿美元。

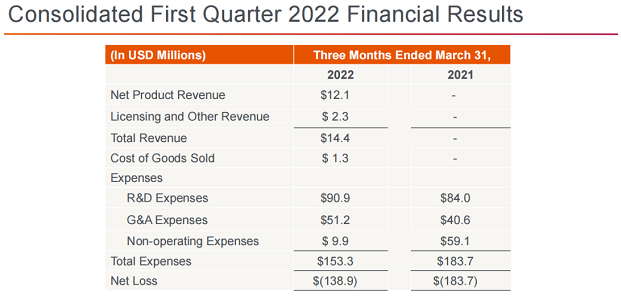
2022年Q1,Apellis总收入1440万美元,其中包括1210万美元的Empaveli(pegcetacoplan)产品收入,以及230万美元与Sobi合作相关的收入。公司第一季度研发费用为9090万美元;一般及行政支出为5120万美元。公司第一季度净亏损1.389亿美元。
截至2022年3月31日,Apellis拥有现金、现金等价物和有价证券共9.653亿美元,累计赤字为18亿美元。加上预期的收入,Apellis估计其资金将足以支持公司在2024年第一季度之前的运营。
药融云数据www.pharnexcloud.com显示,目前国内在做针对补体类的药物企业有:信达生物、领诺医药、康景生物、览屹医药、迈威/普铭生物、科越医药、北海康成、天境生物、舶望制药、朗来/美悦生物等等。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露(正文图片除标注外,均来自企业官方);
https://www.apellis.com/;
新型多肽能否在补体领域弯道超车?,https://mp.weixin.qq.com/s/adM5FfVdr5twBZaAi7OieQ;
世界最贵药物TOP10,第一顺位基因治疗1396万元,https://mp.weixin.qq.com/s/dAhgRy4SnjjaOofYnvAZmg;
Brodsky RA.How I treat paroxysmal nocturnal hemoglobinuria. Blood.2009;113(26):6522-6527. doi:10.1182/blood-2009-03-195966.;
Brodsky RA.Paroxysmal nocturnal hemoglobinuria. Blood. 2014;124(18):2804-2811.doi:10.1182/blood-2014-02-522128.;
Desai, D.,Dugel, P.U. Complement cascade inhibition in geographic atrophy: areview. Eye 36, 294–302 (2022).https://doi.org/10.1038/s41433-021-01765-x.;
Hillmen P,Szer J, Weitz I, et al. Pegcetacoplan versus Eculizumab in ParoxysmalNocturnal Hemoglobinuria. N Engl J Med. DOI: 10.1056/NEJMoa2029073.;
Q&A:Apellis Pharmaceuticals CEO Dr. CedricFrancois,https://chiefexecutive.net/qa-apellis-pharmaceuticals-ceo-dr-cedric-francois/;等等。
<END>
新型多肽Pegcetacoplan
拟打败罕见病重磅药物
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



