海外观察:小分子&基因治疗,PTC专注罕见病创新疗法
在经典的中心法则中,遗传信息从DNA传递给RNA,再从RNA传递到蛋白质,即完成遗传信息的转录与翻译过程。转录后调控(post-transcriptional control)是在RNA水平上对基因的表达进行调控,顾名思义,它发生在基因表达的转录和翻译阶段之间。由于RNA与蛋白质的多样性以及其相互作用的多样性,转录后调控形成了一个巨大的调控网络,并在细胞生理学和病理学(如癌症和神经退行性疾病)中产生深远影响。
PTC Therapeutics这家制药公司从1998年创立之时就在关注转录后调控机制,开发治疗罕见病的口服小分子药物和基因疗法。该公司的创始人Stuart W. Peltz博士和 Allan Jacobson博士当时认为转录后调控机制是一个尚未被开发的生物学领域,蕴藏着治疗罕见遗传病和其他疾病的巨大潜在机会。

通过科学研究和战略收购,公司不断发展壮大,现在PTC Therapeutics专注于发现、开发和商业化临床上差异化的药物,为患有罕见疾病的患者带来益处。其使命是为那些几乎没有治疗选择的患者提供best-in-class的疗法。该公司总部位于美国特拉华州,在全球20多个国家/地区设有办事处或研究实验室,业务足迹遍布全球50多个国家/地区,拥有1200名雇员。2013年PTC Therapeutics登陆纳斯达克,股票代码:PTCT。
商业化产品
杜氏肌营养不良症(DMD)是一种罕见的、危及生命的遗传性肌肉疾病。在DMD治疗领域,该公司拥有两款产品:TranslarnaTM(ataluren)和Emflaza®(deflazacort,地夫可特)。Translarna(ataluren)是全球首款获批治疗DMD的药物(2014,欧盟),最初由PTC Therapeutics的科学家与宾夕法尼亚大学的Lee Sweeney实验室合作发现,已在欧盟、巴西、俄罗斯获批用于治疗2岁及以上无义突变型杜氏肌营养不良症(nmDMD)患者。药融圈旗下药融云数据www.pharnexcloud.com显示,该药物是一款作用于无义突变的口服小分子药物,其口服混悬液颗粒在国内已获批临床,拟开发用于nmDMD。Emflaza(deflazacort,地夫可特)是美国FDA批准的首个DMD治疗药物(2017,美国),最初由西班牙公司Faes Farma, S.A.,研发,后由Marathon Pharmaceuticals引进美国,2017年,Marathon以1.4亿美元将该药卖给PTC Therapeutics。Emflaza是一种类固醇激素类药物,具有免疫抑制作用,在美国被批准用于治疗2岁及以上的DMD患者。
Tegsedi®(inotersen)和Waylivra®(volanesorsen):2018年,PTC Therapeutics与Ionis Pharmaceuticals子公司AkceaTherapeutic达成合作和许可协议,PTC Therapeutics获得Tegsedi和Waylivra在拉丁美洲和加勒比地区国家的商业化的权利,用于治疗罕见病。Tegsedi(inotersen)是一款靶向转甲状腺素蛋白(TTR)的反义寡核苷酸(ASO)药物,已在美国、加拿大、欧盟和巴西获得批准用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR淀粉样变性)成年患者的1期或2期多发性神经病。该药物是全球首款获批治疗hATTR的药物(2018,欧盟)。Waylivra(volanesorsen)是一款靶向ApoC-III的ASO药物,已在欧盟和巴西获得上市许可,用于治疗家族性乳糜微粒血症综合征(FCS),该药物也是全球首款获批的FCS治疗药物(2019,欧盟)。PTC Therapeutics已经在巴西启动了Tegsedi治疗hATTR淀粉样变性和Waylivra用于治疗FCS的商业化工作。此外,该公司于2021年12月向巴西国家卫生局(ANVISA)提交了申请,以寻求批准Waylivra用于治疗家族性部分脂肪营养不良(FPL),预计将在2022年下半年做出监管决定。
脊髓性肌萎缩症(SMA)是一种严重的罕见进行性神经肌肉疾病,由存活运动神经元1(SMN1)基因突变引起。Evrysdi®(risdiplam,利司扑兰)是一款SMN2剪接调节剂,旨在治疗由导致SMN蛋白缺乏的染色体5q突变引起的SMA。该药物源自PTC Therapeutics与罗氏以及SMA基金会(脊髓性肌肉萎缩基金会)的合作,于2020年8月获美国FDA批准,用于治疗成人和2个月及以上儿童SMA患者,并于2021年3月获得欧盟委员会(EC)批准用于治疗在临床上被诊断为SMA 1型、2型或 3型或携带1到4个SMN2拷贝的2个月及以上5q SMA患者。Evrysdi还于2020年10月在巴西和2021年6月在日本获得了治疗SMA的上市许可。2022年1月,美国FDA授予Evrysdi(risdiplam)的补充新药申请(sNDA)优先审查资格,将扩大其适应症范围,以包括2个月以下患有经基因证实的SMA症状前的婴儿。该药物是一款口服小分子药物,2021年6月,其在国内获批用于治疗2月龄及以上的SMA患者,中文商品名:艾满欣®。

Translarna遭FDA三次拒绝,在美前途几何
杜氏肌营养不良症(DMD)患者的治疗选择十分有限。据了解,无义突变占所有DMD基因突变类型的13%,这类突变会造成终止密码子提前出现,从而导致蛋白合成过程提前终止,生成功能缺失的抗肌萎缩蛋白。Translarna(ataluren)通过与终止密码子结合,使核糖体对mRNA上过早的无义终止信号进行“通读”(Read-through,即核糖体无视终止密码子),让细胞能够产生全长的功能性蛋白,进而恢复抗肌萎缩蛋白的正常表达,且似乎对终止密码子“UGA”特别有效。其分子结构如下:
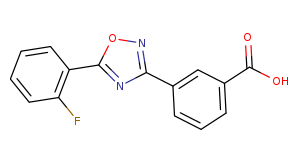
Translarna(ataluren)作为全球首款获批治疗DMD的药物,虽然早在2014年就在欧盟获得批准,但在美国却遭遇FDA多次拒绝,至今仍未获批;新药之路总是充满崎岖。
2016年2月,PTC Therapeutics宣布美国FDA拒绝受理Translarna(ataluren)的新药申请,理由是“该申请不够完整,无法进行实质性审查”。因为在2015年10月,PTC Therapeutics公布的Translarna(ataluren)治疗杜氏肌营养不良症患者的3期ACT DMD试验中,虽然显示出了临床益处,但未达主要终点。
后来,该公司就FDA有关部门发出的拒绝受理信函提出上诉,但该上诉在2016年10月遭FDA驳回。当时,竞争对手Sarepta Therapeutics的DMD药物Exondys 51(eteplirsen)获FDA有条件批准,而在那时,Exondys 51只是被证明提高了抗肌营养不良蛋白水平,其临床受益还未证实。这让PTC Therapeutics认为FDA并未公平、全面地考虑Translarna(ataluren)的数据,并打算向FDA的更高级别部门提出上诉。
2017年第一季度,该公司再次向FDA递交NDA,但在10月,FDA拒绝了Translarna(ataluren)的新药上市申请,认为“确定ataluren治疗nmDMD有效性的数据没有说服力”。FDA要求PTC Therapeutics至少提供一个设计合理的阳性临床试验结果。
2021年2月,PTC Therapeutics公布了新的Study 045试验的结果,在完成研究的18名患者中,虽然抗肌萎缩蛋白的产生增加了9%,但并未达到具有统计学意义的水平,该试验未达到预先设定的主要终点。因此PTC Therapeutics只能等到2022年年中公布安慰剂对照的Study 041试验的结果,若结果积极,该公司预计将向FDA重新递交Translarna(ataluren)的NDA申请。
主要在研产品管线
PTC Therapeutics致力于利用开创性科学技术为患者开发治疗方法。随着公司的发展,PTC的技术平台已从基于RNA作用机制的专业知识拓展到了包括基因治疗在内的多种疗法,在研产品治疗领域包含遗传性疾病、肿瘤学、病毒学等。
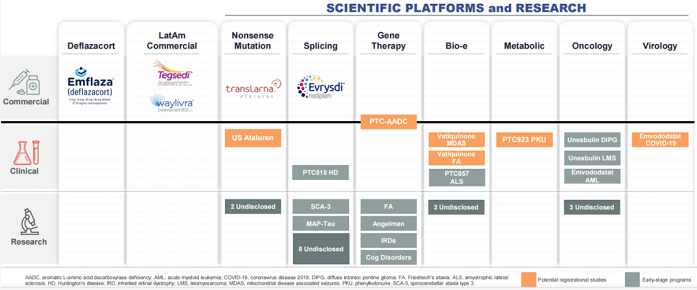
RNA剪接平台
PTC开发了一种高通量药物发现平台,能够识别具有调节pre-mRNA剪接功能的小分子修饰物,并筛选出可以修饰基因可变剪接的小分子候选药物。这些候选药物可促进特定外显子插入mRNA,或跳过成熟mRNA中不需要的外显子,以调节异常的突变。
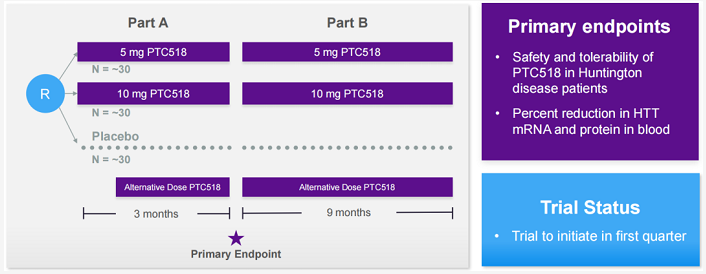
PTC518是该平台的主要候选产品,正在被开发用于治疗亨廷顿病(亨廷顿舞蹈症,HD)。该产品是一种口服小分子药物,可选择性靶向并减少导致神经元损伤和死亡的突变亨廷顿蛋白质。1期临床数据表明,PTC518显示出剂量依赖性降低HTT mRNA和蛋白质的产生,达到了减少30-50%的水平。此外,PTC518还可穿透血脑屏障且外排极少,使其能够靶向HD根本病因的关键因素。2022年3月30日,PTC宣布启动PTC518针对HD患者的2期PIVOT-HD试验。
基因治疗平台
PTC的基因治疗平台源自2018年,该公司收购了基因疗法公司Agilis Biotherapeutics并获其创新基因疗法组合。其基因疗法背后的原理在于将具有疗效的基因在目标位点精准表达,替代突变基因的功能,从而达到长期的疗效。PTC-AADC(eladocagene exuparvovec,原为GT-AADC)是产品组合中进度最为领先的基因疗法,被开发用于治疗芳香族L-氨基酸脱羧酶(AADC)缺乏症。AADC缺乏症是一种极为罕见的中枢神经系统遗传性疾病,由多巴脱羧酶(DDC)基因突变引起,导致体内缺乏AADC酶,该酶负责关键神经递质多巴胺和5-羟色胺合成的最后一步。
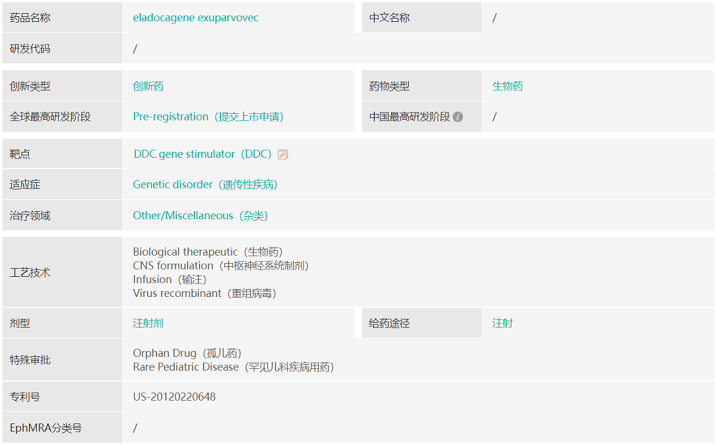
图源:药融云数据库
PTC-AADC利用腺相关病毒(AAV)载体将正常DDC基因引入体内以支持这些关键神经递质的产生。目前该病尚未有靶向根本病因的疗法获批。2021年9月,PTC公布了PTC-AADC最新的五年分析结果,PTC-AADC一次性基因治疗持续改善了患者的运动和认知功能;患者呼吸道感染率从12个月时的平均每年2.4次下降到2年时的每年0.6次,和5年时的每年0.3次;几乎所有的患者在12个月内从低于第三个百分位数的基线体重增加了适合其年龄的体重。目前该产品已在欧盟提交上市申请,目前欧盟CHMP在2022年5月给出了最终积极支持批准的意见。此外,该公司预计在2022年第三季度向美国FDA提交PTC-AADC的BLA申请。
Bio-e平台
PTC的Bio-e平台由靶向氧化还原酶的小分子化合物组成,这些酶调节氧化应激和炎症通路,这些通路对许多中枢神经系统疾病的病理学至关重要。该平台利用电子转移化学或氧化还原反应方面的专业知识来调节当前药物开发方法无法调节的关键生物过程。
Bio-e平台开发进度领先的化合物Vatiquinone(前称PTC743)是一款在研口服小分子药物,属于苯醌类药物,靶向15-脂氧合酶(15-LO)——一种调节炎症和氧化应激的关键酶中枢,在线粒体疾病和中枢神经系统疾病中起重要作用。2020年第三季度,PTC开启了关键2/3期MIT-E试验,以评估该药在线粒体疾病相关癫痫(MDAS)患者中的作用,预计2022年第四季度获得结果。
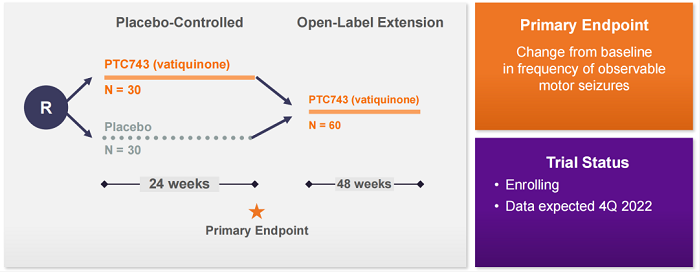
该公司还在2020年第四季度开启了关键3期MOVE-FA试验,以评估Vatiquinone在Friedreich共济失调(FA)患者中的安全性与疗效,预计将在2023年第二季度获得结果。

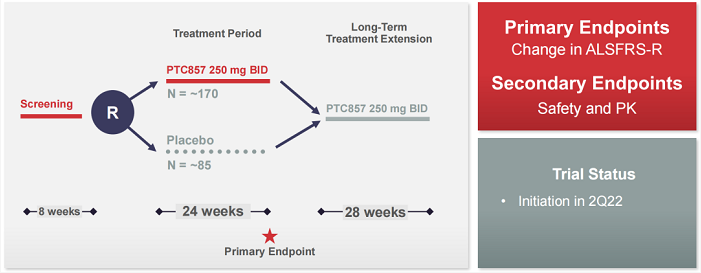
PTC857也是一款靶向15-LO的口服小分子药物,目前该公司启动了PTC857用于治疗肌萎缩性侧索硬化症(ALS)的2期CardinALS试验。
罕见代谢疾病
2020年,PTC收购了专注于罕见代谢疾病的生物技术公司Censa Pharmaceuticals,并获其产品组合。PTC923(sepiaterin,前称CNSA-001)是一款合成的口服四氢生物蝶呤(BH4)前体制剂,BH4是多种代谢产物合成的关键酶辅因子。PTC923正在被开发用于治疗苯丙酮尿症(PKU)等与BH4生化通路缺陷有关的罕见代谢性疾病。2019年12月,PTC宣布PTC923作为PKU潜在治疗方法的2期试验达到了其主要和次要终点,与基线和对照组相比,试验组患者血液苯丙氨酸(Phe)水平实现具有统计学意义和临床意义的降低。该公司于2021年第三季度启动了PTC923针对PKU的3期APHENITY试验,预计结果将在2022年底前披露。

肿瘤学
目前,PTC有两款处于临床开发阶段的抗肿瘤候选药物。Unesbulin(前称PTC596)是一款口服小分子微管蛋白抑制剂,通过抑制微管蛋白聚合来抑制肿瘤细胞进入G2/M期,包括肿瘤干细胞。该药正在被开发用于治疗平滑肌肉瘤(LMS)和弥漫性内生性脑桥胶质瘤(DIPG)。临床前研究显示unesbulin与达卡巴嗪联合使用对于LMS具有协同作用,1期剂量递增研究显示unesbulin与达卡巴嗪联用对于LMS患者具有良好的耐受性。目前该公司启动了unesbulin治疗LMS患者的2期SUNRISELMS试验。
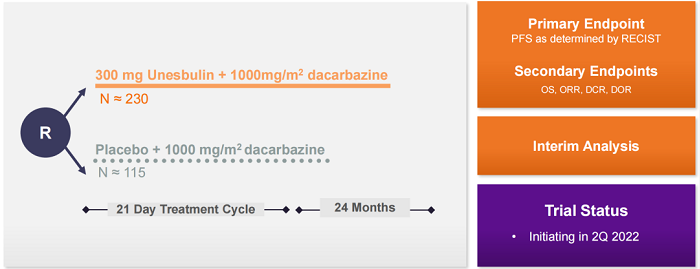
此外。该公司预计还将在2022年第三季度启动一项unesbulin治疗DIPG的2期试验。
Emvodstat是一款小分子二氢乳清酸脱氢酶(DHODH)抑制剂,可抑制嘧啶核苷酸从头合成,被开发用于治疗急性髓系白血病(AML)。PTC在2021年第四季度完成了该药用于AML的1期试验评估,后续肿瘤适应症开发计划未披露。不过该候选产品也被开发用于治疗COVID-19。
病毒学
2020年6月,PTC启动了一项2/3期临床试验,旨在评估emvodstat在COVID-19住院患者中的疗效和安全性。2021年2月,公司宣布完成2/3期FITE19试验的第一阶段部分,预计结果将在2022年上半年公布。该公司认为emvodstat或可从病毒的复制和感染后的炎症反应方面起作用。
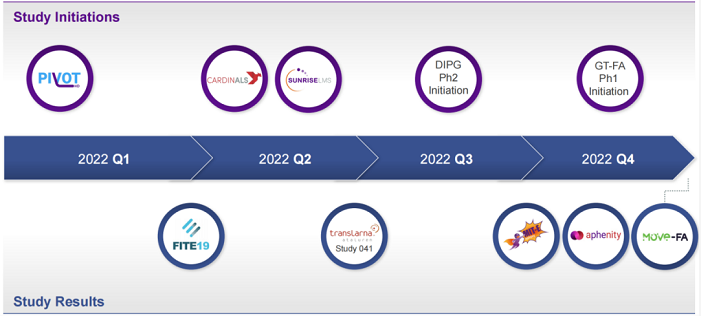
下图为2022年PTC临床试验计划(信息更新至2022年1月):
业绩状况
2021财年,PTC Therapeutics总收入为5.386亿美元,同比增长41.4%;其中净产品收入达4.289亿美元,同比增长29.3%;合作和特许权收入1.097亿美元,同比增长131.6%。全年研发支出达5.407亿美元。
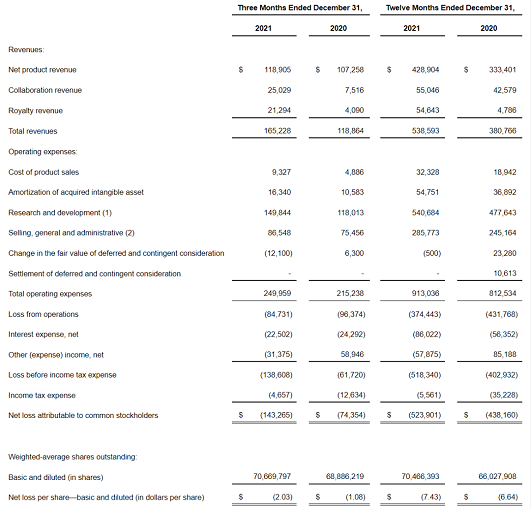
2022年第一季度,公司总收入为1.487亿美元,同比增长26.1%;其中净产品收入达1.298亿美元,同比增长42.2%;合作和特许权收入1890万美元,同比减少29.1%。第一季度研发支出达1.4亿美元。
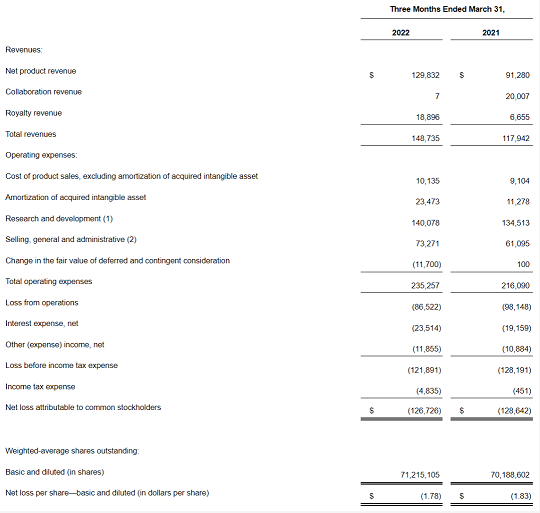
截至2022年3月31日,该公司拥有现金、现金等价物和有价证券共5.878亿美元,预计2022全年总收入约为7~7.5亿美元。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
Dassi E. Handshakes and Fights: The Regulatory Interplay of RNA-Binding Proteins. Front Mol Biosci. 2017;4:67. Published 2017 Sep 29. doi:10.3389/fmolb.2017.00067.;
Wassenberg et al. Consensus guideline for the diagnosis and treatment of aromatic l-amino acid decarboxylase (AADC) deficiency. Orphanet J Rare Dis. 2017; 12:12.;
https://www.ptcbio.com/;
https://www.genengnews.com/magazine/firm-aims-to-regulate-rna-in-rare-diseases/;
https://www.fiercebiotech.com/biotech/small-cap-ptc-tumbles-as-fda-rejects-it-again-duchenne;等等。
<END>
 药融圈社群
药融圈社群


 您现在的位置:
您现在的位置:



